Классификация по типу разрыва связей
Ковалентные связи могут разрываться по-разному. Рассмотрим типы разрыва связей.
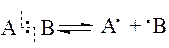 Если при разрыве химической связи у каждого из атомов остаётся по одному электрону, такой тип разрыва называют гомолитическим, или гомолизом (от греческих слов: гомо – одинаковый, лизис – расщепление). Схематично это можно показать следующим образом:
Если при разрыве химической связи у каждого из атомов остаётся по одному электрону, такой тип разрыва называют гомолитическим, или гомолизом (от греческих слов: гомо – одинаковый, лизис – расщепление). Схематично это можно показать следующим образом:
Такой тип разрыва характерен для неполярных и малополярных связей. Ему способствуют определённые внешние факторы: облучение, нагревание, проведение реакции в газовой фазе или в среде неполярного растворителя (чтобы исключить поляризацию связи).
Полученные частицы не заряжены (электронейтральны), имеют неспаренный электрон, поэтому очень активны. Нейтральные частицы с неспаренным электроном называются свободными радикалами, отсюда другое название гомолитического типа разрыва связи – радикальный тип.
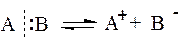 Если при разрыве связи пара электронов остаётся у одного из атомов, такой тип разрыва называют гетеролитическим, или гетеролизом (гетерос – разный, другой).
Если при разрыве связи пара электронов остаётся у одного из атомов, такой тип разрыва называют гетеролитическим, или гетеролизом (гетерос – разный, другой).
Такой тип разрыва характерен для полярных связей. Ему способствуют наличие полярного растворителя, нагревание, катализаторы (кислоты или щёлочи).
В результате разрыва связи образовались заряженные частицы – ионы, поэтому другое название гетеролитического типа разрыва связи – ионный тип.
Итак, по типу разрыва связей реакции классифицируют на гомолитические (радикальные) и гетеролитические (ионные).
Гетеролитические реакции классифицируют дальше в зависимости от электронной природы атакующей частицы. Их подразделяют на электрофильные и нуклеофильные.
Электрофильные реагенты (электрофилы, Е, «любящие электроны») – частицы с полным положительным зарядом или нейтральные молекулы с недостатком электронной плотности на каком-то из атомов. Например: H+, NO2+, CH3+, Cl+, SO3.
Нейтральная молекула SO3 является электрофилом из-за перераспределения электронной плотности в молекуле.
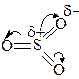 Три электроотрицательных атома кислорода смещают электронную плотность с серы на себя,
Три электроотрицательных атома кислорода смещают электронную плотность с серы на себя,
и на атоме серы возникает большой по
величине частичный положительный заряд
(это обозначается как δ+).
Электрофилы атакуют в молекуле субстрата центры с повышенной электронной плотностью.
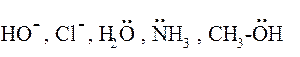 Нуклеофильные реагенты (нуклеофилы, Nu, «любящие ядро») – частицы с полным отрицательным зарядом или молекулы с неподелённой электронной парой. Например:
Нуклеофильные реагенты (нуклеофилы, Nu, «любящие ядро») – частицы с полным отрицательным зарядом или молекулы с неподелённой электронной парой. Например:
Нуклеофилы способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с пониженной электронной плотностью.
При характеристике органических реакций чаще пользуются критериями различных классификаций, например, радикальное замещение (SR), электрофильное присоединение (AE), нуклеофильное замещение (SN).
Итак, мы рассмотрели, какие типы реакций вообще возможны в органических соединениях и теперь можем перейти к общим закономерностям их реакционной способности как химической основе биологического функционирования органических молекул.
