Взаимодействие с протонными соединениями (как основания Бренстеда)
Магний- и литийорганические соединения обладают сильными оснОвными свойствами, поэтому легко реагируют с различными протонными кислотами (CH-, NH-, OH-, SH-кислотами), превращаясь в алканы.
Таким способом можно получать магниевые и литиевые соли разнообразных слабых кислот – алкоголяты, феноляты, тиоляты, амиды щелочных металлов, например:
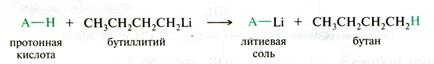
Рис. 21.10. Схема реакции взаимодействия литийорганических соединений с протонными кислотами
Вода, спирты, фенолы (Ar–OH), первичные и вторичные амины, карбоновые кислоты, т.е. соединения с подвижным атомом Н, гидролизуют магнийорганические соединенияреактивы Гриньяра с образованием углеводородов:
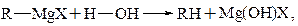
Рис. 21.11. Схема реакции взаимодействия магнийорганических соединений с протонными кислотами
т.е. Н+– как электрофил, атакует Rδ- как основание.
1.4.2. Реакции с галогенпроизводными углеводородов (как основания Брёнстеда).
1. ОснОвные свойства у литий- и магнийорганических соединений выражены в большей степени, чем нуклеофильные.
2. Благодаря этому, при низких температурах с помощью литийалкилов удается отщеплять протоны от соединений, имеющих различные электрофильные центры (галогеналканы имеют два реакционных центра: электрофильныйцентр и СН-кислотный центр) центры.
!!! Так как металлорганические соединения являются более сильными основаниями, чем нуклеофилами, то предпочтительнее протекают реакции элиминирования, чем нуклеофильного замещения.
Например, при взаимодействии хлороформа с бутиллитием в тетрагидрофуране происходит отрывпротона от молекулы хлороформа, а не замещение галогена:
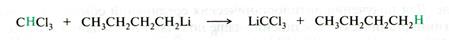
Рис. 21.12. Схема реакции литийорганических соединений с галогенпроизводными углеводородов
1.4.3. Карбонильными соединениями.
Взаимодействие альдегидов и кетонов с магнийорганическими соединениями RMgHal (реактивами Гриньяра) является одним из универсальных способов синтеза спиртов: из формальдегида получают первичные спирты, из других альдегидов – вторичные спирты, а из кетонов – третичные:
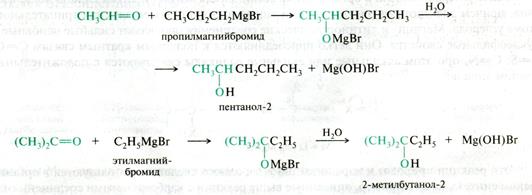
Рис. 21.13. Схема реакции реактивов Гриньяра с карбонильными соединениями
1. На первой стадии реакции, которая проводится в среде безводного диэтилового эфира, происходит нуклеофильное присоединение магнийорганического соединения к альдегиду или кетону (разрыв двойной связи и присоединение через атом кислорода).
2. На второй стадии реакции образовавшийся магниевый алкоголят гидролизуется разбавленной минеральной кислотой или хлоридом аммония.
Аналогично магнийорганическим соединениям происходит присоединение литийорганических соединений:
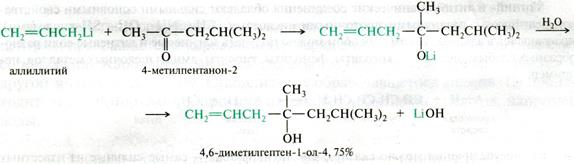
Рис. 21.14. Схема реакции литийорганических соединений с карбонильными соединениями
Литийорганические соединения более реакционоспособны, чем реактивы Гриньяра
4.1.4. Производными карбоновых кислот.
Сложные эфиры присоединяют реактивы Гриньяра с образование третичных спиртов:
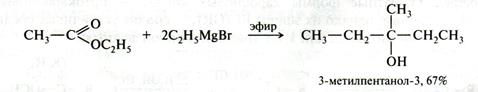
Рис. 21.14. Схема реакции реактивов Гриньяра с производными карбоновых кислот
1. Вначале одна молекула магнийорганического соединения присоединяется к карбонильной группе молекулы сложного эфира.
2. От образовавшегося продукта присоединения отщепляется оксогруппа, что приводит к получению кетона, который присоединяет вторую молекулу реактива Гриньяра.
3. Гидролиз магниевого алкоголята проводят разбавленной минеральной кислотой:
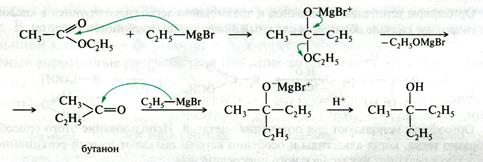
Рис. 21.15. Схема механизма реакции реактивов Гриньяра с производными карбоновых кислот
Литийорганические соединения взаимодействуют со сложными эфирами органических кислот подобно реактивам Гриньяра с образованием третичных спиртов
Оксиранами
1. Металлорганические соединения способны осуществлять нуклеофильную атаку и на тетрагональные атомы углерода.
2. В качестве субстратов в этом случае могут выступать оксираны (эпоксиды) и т. д.
Например, при взаимодействии эпоксидов с магнийорганическими соединениями образуются первичные спирты, а углеродный скелет молекулы увеличивается на два атома:
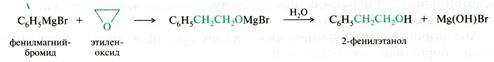
Рис. 21.16. Схема реакции реактивов Гриньяра с оксиранами (эпокситаами)
Под действием нуклеофилов раскрытие цикла происходит по механизму бимолекулярного нуклеофильного замещения SN2.
Диоксидом углерода
Введение литийорганических соединений в избыток двуокиси углерода (их выливают на твердую углекислоту) приводит к литиевым солям карбоновых кислот, которые при действии соляной кислоты превращаются в карбоновые кислоты:
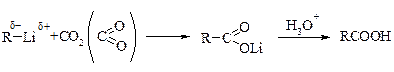
т. е. имеет место присоединение углеводородного радикала к полярной С=О связи.
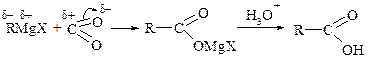
Эта реакция широко применяется при исследовании строения литийорганических соединений и для синтеза карбоновых кислот.
