Комплексонометрическое и осадительное титрование
1. КОМПЛЕКСОНОМЕТРИЯ ОСНОВАНА НА ПРОТЕКАНИИ РЕАКЦИИ
1) образования комплексов ионов металлов и аминополикарбоновых кислот, т.е. комплексонатов
2) взаимодействия определяемых ионов с некоторыми органическими реактивами
3) комплексообразования
4) взаимодействия иона комплексообразователя с некоторыми органическими реактивами
2. ХЕЛАТЫ – ЭТО (ВЫБЕРИТЕ НАИБОЛЕЕ ТОЧНЫЙ ОТВЕТ)
1) комплексные соединения
2) внутрикомплексные соединения
3) комплекс ионов металла и связанных с ним лигандов
4) соединения, в которых центральный атом и полидентатный лиганд образуют цикл
ВИД
3. ФОРМУЛА ХИМИЧЕСКОГО СТРОЕНИЯ ХЕЛАТА ИМЕЕТ
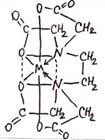 1) 1) | 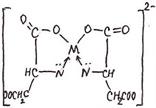 2) 2) |
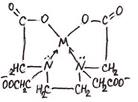 3) 3) | 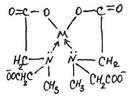 4) 4) |
4. ДЕНТАТНОСТЬ ЛИГАНДА ОБУСЛОВЛЕНА
1) числом связей, образованных по донорно-акцепторному механизму
2) числом донорных атомов в молекуле лиганда, участвующих в образовании координационных связей с центральным атомом
3) числом химических связей между ионом- комплексообразователем и лигандом
4) числом связей, образованных по свободнорадикальному механизму
5. МЕТАЛЛОИНДИКАТОРЫ – ЭТО ВЕЩЕСТВА
1) органического или неорганического происхождения, используемые для установления КТТ
2) образующие с определяемым катионом яркоокрашенные комплексы, которые менее устойчивы, чем соответствующие комплексонаты
3) образующие в выбранной области рН достаточно устойчивые комплексы
4) органического или неорганического происхождения, образующие окрашенные соединения с определяемым ионом
6. ПРИ ОПРЕДЕЛЕНИИ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ ИСПОЛЬЗУЕТСЯ ТИТРОВАНИЕ
1) прямое
2) обратное
3) заместительное
4) вытеснительное
7. В КОМПЛЕКСОНОМЕТРИИ ПЕРВИЧНЫМИ СТАНДАРТНЫМИ ВЕЩЕСТВАМИ ЯВЛЯЮТСЯ
1) (NH4)2Fe(SO4)2·6H2O, Na2C2O4, K[Fe(CN)6]
2) Na2CO3, H2C2O4·2H2O, Na2B4O7·10H2O
3) MgCl2·10H2O, ZnCl2, BiCl3
4) NaBr, Ba(NO3)2
8. НОСИТЕЛЯМИ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ ЯВЛЯЮТСЯ 1) CO32-, HCO3-
2) SO42-
3) Fe3+
4) Mg2+и Ca2+
9. ДЛЯ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ИОНОВ КАЛЬЦИЯ В СИЛЬНОЩЕЛОЧНОЙ СРЕДЕ ИСПОЛЬЗУЕТСЯ МЕТАЛЛОИНДИКАТОР
1) мурексид
2) эриохром черный Т
3) пирокатехиновый фиолетовый
4) ксиленоловый оранжевый
10. РАСТВОРОМ ЭДТА МОЖНО ОТТИТРОВАТЬ МЕТОДОМ ОБРАТНОГО ТИТРОВАНИЯ СЛЕДУЮЩИЕ КАТИОНЫ
1) Ca2+ и Mg2+
2) Cu2+и Zn 2+
3) Fe3+
4) Al3+ и Cr3+
11. С ДИТИЗОНОМ В ПРИСУТСТВИИ ЭДТА РЕАГИРУЮТ КАТИОНЫ
1) Zn2+
2) Hg2+
3) Cd2+
4) Al3+
5) Cu2+
13. Са2+
ТИТРУЮТ РАСТВОРОМ ЭДТА С ИНДИКАТОРОМ
МУРЕКСИДОМ В СРЕДЕ
1) щелочной
2) нейтральной
3) кислой
4) вообще нельзя титровать
14. С ЭДТА В СТЕХИОМЕТРИЧЕСКОМ СООТНОШЕНИИ 2:1 РЕАГИРУЮТ МЕТАЛЛЫ
1) W5+и Mo 5+
2) Mg и Са
3) Zr и Hf
15. НЕОБХОДИМОСТЬ ПРИМЕНЕНИЯ МЕТОДА ОБРАТНОГО ТИТРОВАНИЯ В КОМПЛЕКСОНОМЕТРИИ ОБУСЛОВЛЕНА
1) отсутствием подходящих маскирующих веществ
2) слишком медленным протеканием реакции
16. ПРИ ТИТРОВАНИИ СаО РАСТВОРОМ ЭДТА ЭКВИВАЛЕНТНАЯ МАССА СаО РАВНА
1) Э = м.м.СаО/2
2) Э = м.м.СаО/4
3) Э = м.м.СаО/6
4) Э = м.м.СаО/1
17. НА КРИВОЙ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ НА ВЕЛИЧИНУ СКАЧКА ВЛИЯЮТ ФАКТОРЫ
1) константа устойчивости комплексоната и исходная концентрация металла
2) рН и наличие других металлов, вступающих в реакцию с
ЭДТА
3) наличие посторонних веществ, являющихся лигандами для
титруемого металла и температура
4) все перечисленные факторы
18. КРИВУЮ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ СТРОЯТ В КООРДИНАТАХ:
1) pMe - vЭДТА, мл
2) pMe - pH
3) lgb - pH
19. ДЛЯ СТАНДАРТИЗАЦИИ РАСТВОРА ЭДТА МОГУТ БЫТЬ ИСПОЛЬЗОВАНЫ ВЕЩЕСТВА
1) раствор Аl3+
2) раствор Са2+
3) раствор Сr3+
4) растворы всех перечисленных металлов
20. КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ Аl3+ ПРОВОДЯТ МЕТОДОМ ОБРАТНОГО ТИТРОВАНИЯ ИЗ-ЗА
1) недостаточно контрастного перехода окраски идикатора
2) мещающих побочных реакций
3) недостаточно высокой скорости образования комплексоната
21. В МОЛЕКУЛЕ ЭДТА ПРИСУТСТВУЮТ ФУНКЦИОНАЛЬНО- АНАЛИТИЧЕСКИЕ ГРУППИРОВКИ
1) карбонильная и третичный азот
2) оксигруппа и азогруппа
3) карбоксильная и третичный азот
22. ШИРОКОЕ ИСПОЛЬЗОВАНИЕ КОМПЛЕКСОНОВ В АНАЛИТИЧЕСКОЙ ХИМИИ ОБУСЛОВЛЕНО СЛЕДУЮЩЕЙ ОСОБЕННОСТЬЮ ВЗАИМОДЕЙСТВИЯ ИХ С С ИОНАМИ МЕТАЛЛОВ
1) полидентатностью комплексонов
2) высокой устойчивостью комплексонатов металлов и простой стехиометрией ( М: Y = 1 : 1 )
3) различной скоростью образования комплексонатов металлов
4) различной и характерной окраской комплексонатов
5) доступностью реагентов
23. "ХЕЛАТЫ" - ЭТО
1) комплексы с донорно-акцепторной связью металл - лиганд
2) комплексы, у которых центральный атом включен в циклическую структуру
3) комплексы, при образовании которых выделяются ионы Н3О+
4) соединения с органическими реагентами
5) нет правильного ответа
24. “ДЕНТАТНОСТЬ” ЛИГАНДА ЭТО
1) число молекул воды, вытесняемое из аквакомплексов металла при комплексообразовании
2) число координационных мест, занимаемых лигандом во внутренней координационной сфере
3) число атомов, образующих функционально-аналитическую группировку
4) число атомов, присоединяемых во внешней координационной сфере.
5) нет правильного oтвета
25. УКАЖИТЕ, ПРИ КАКИХ ЗНАЧЕНИЯХ рН ВОЗМОЖНО ПРИМЕНЕНИЕ МЕТОДА МОРА ДЛЯ ФИКСАЦИИ КОНЕЧНОЙ ТОЧКИ ТИТРОВАНИЯ В АРГЕНТОМЕТРИИ
| 1) | |
| 2) | |
| 3) | |
| 4) |
26. ТОЧКА ПЕРЕГИБА КРИВОЙ ОСАДИТЕЛЬНОГО ТИТРОВАНИЯ С ТОЧКОЙ ЭКВИВАЛЕНТНОСТИ ДЛЯ ОСАДКОВ ТИПА МеА2ИЛИ Ме2А БУДЕТ СОВПАДАТЬ В СЛУЧАЕ
1) не совпадает
2) совпадает
27. В КАКОМ ИЗ ПЕРЕЧИСЛЕННЫХ СЛУЧАЕВ ОШИБКА ТИТРОВАНИЯ ПРИ АРГЕНТОМЕТРИЧЕСКОМ ОПРЕДЕЛЕНИИ ЙОДИДА БУДЕТ МЕНЬШЕ
1) в присутствии бромида
2) в присутствии хлорида
3) в присутствии фторида
28. В КАЧЕСТВЕ ПЕРВИЧНОГО СТАНДАРТА В АРГЕНТОМЕТРИИ ИСПОЛЬЗУЕТСЯ
1) нитрат серебра
2) хлорид натрия
3) хлорид кальция
29. АРГЕНТОМЕТРИЧЕСКИМ МЕТОДОМ МОРА МОЖНО ОПРЕДЕЛЯТЬ
1) йодид
2) роданид
3) хромат
4) бромид
30. ПРИ МЕРКУРОМЕТРИИ В КАЧЕСТВЕ ПЕРВИЧНОГО СТАНДАРТА ИСПОЛЬЗУЕТСЯ
1) каломель
2) хлорид кальция
3) хлорид натрия
4) сулему
31. ПРИ МЕРКУРОМЕТРИЧЕСКОМ ОПРЕДЕЛЕНИИ ХЛОРИДОВ ПРИМЕНЯЮТ ИНДИКАТОР
1) роданид железа (III)
2) дифенилкарбазон
3) эозин
4) дихлорфлуоресцеин
5) бихромат калия
32. ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА В ОСАДИТЕЛЬНОМ ТИТРОВАНИИ ОЗНАЧАЕТ
1) точку эквивалентности
2) конечную точку титрования
3) момент электронейтральности частиц осадка
33. НАИБОЛЕЕ СИЛЬНОЕ ВЛИЯНИЕ НА ВЕЛИЧИНУ СКАЧКА ТИТРОВАНИЯ В ОСАДИТЕЛЬНЫХ МЕТОДАХ ОКАЗЫВАЕТ
1) величина ПР осадка
2) концентрация растворов
3) заданная точность определения при титровании
34. ПРИ АРГЕНТОМЕТРИЧЕСКОМ ОПРЕДЕЛЕНИИ ЙОДИДА ТИТРОВАНИЕМ ДО ТОЧКИ ПРОСВЕТЛЕНИЯ ПРИСУТСТВИЕ В РАСТВОРЕ МНОГОЗАРЯДНЫХ КАТИОНОВ ДОПУСТИМО
1) нет
2) да
3) не всегда
35. НА КРИВОЙ ТИТРОВАНИЯ РАСТВОРА ЯНТАРНОЙ КИСЛОТЫ РАСТВОРОМ NaOH СКАЧКОВ ТИТРОВАНИЯ
| 1) | |
| 2) | |
| 3) | |
| 4) | ни одного |
36. НА КРИВОЙ ТИТРОВАНИЯ РАСТВОРА Н3РО4РАСТВОРОМ NaOH СКАЧКОВ ТИТРОВАНИЯ
| 1) | |
| 2) | |
| 3) | |
| 4) | ни одного |
37. ПРИ ТИТРОВАНИИ РАСТВОРА Н3РО4
РАСТВОРОМ NaOH
СОСТАВ РАСТВОРА ВО ВТОРОЙ ТОЧКЕ ЭКВИВАЛЕНТНОСТИ
БУДЕТ
1) NaH2PO4
2) NaH2PO4+ Na2HPO4
3) Na2HPO4
4) Na2HPO4+ Na3PO4
5) H3PO4+Na3PO4
38. ПРИ ТИТРОВАНИИ РАСТВОРА Н3РО4
РАСТВОРОМ NaOH
СОСТАВ РАСТВОРА В ПЕРВОЙ ТОЧКЕ ЭКВИВАЛЕНТНОСТИ
БУДЕТ
1) NaH2PO4
2) NaH2PO4+ Na2HPO4
3) Na2HPO4
4) Na2HPO4+ Na3PO4
5) H3PO4+Na3PO4
39. ПРИ ТИТРОВАНИИ РАСТВОРА NH3
РАСТВОРОМ НСI
РАСТВОР В ТОЧКЕ НЕЙТРАЛЬНОСТИ СОДЕРЖИТ
1) буферную смесь
2) слабое основание
3) амфолит
40. ПРИ ТИТРОВАНИИ СЛАБОЙ ОДНООСНОВНОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ РАСТВОР В ТОЧКЕ НЕЙТРАЛЬНОСТИ СОДЕРЖИТ
1) амфолит
2) слабое основание
3) эквимолярную смесь слабого основания и сопряженной с ним кислоты
4) кислоту, сопряженную с основанием
5) буферную смесь
41. СМЕШАННЫЙ ИНДИКАТОР НЕОБХОДИМО ИСПОЛЬЗОВАТЬ В СЛУЧАЕ
1) титрования СН3СООН раствором NaOH
2) титрования СН3СООН раствором (СН3)2NH
3) титрования NaOH раствором НСООН
4) титрования НСl раствором NaOH
42. ПРИ ТИТРОВАНИИ 0,1М РАСТВОРА НСl 0,1М РАСТВОРОМ NaOH В ПРИСУТСТВИИ NH4Cl СЛЕДУЕТ ИСПОЛЬЗОВАТЬ ИНДИКАТОР
1) лакмус
2) метиловый оранжевый
3) фенолфталеин
4) метиловый красный
5) бромфеноловый синий
43. ПРИ ТИТРОВАНИИ 0,1М РАСТВОРА NaOH 0,1М РАСТВОРОМ НСl В ПРИСУТСТВИИ СН3СООNa СЛЕДУЕТ ИСПОЛЬЗОВАТЬ ИНДИКАТОР
1) метиловый оранжевый
2) лакмус
3) фенолфталеин
4) метиловый красный
44. NaHCO3
НЕЛЬЗЯ ТИТРОВАТЬ РАСТВОРОМ НСl С
ФЕНОЛФТАЛЕИНОМ ПОСКОЛЬКУ
1) NaHCO3– слабая кислота
2) рТ индикатора совпадает с рН раствора NaHCO3
3) NaHCO3– очень слабое основание
45. ХРОМОФОРНЫЕ ГРУППИРОВКИ В МОЛЕКУЛЕ ИНДИКАТОРА ОБУСЛОВЛИВАЮТ
1) окраску индикатора
2) окраску индикатора и усиливают ее
3) усиливают окраску индикатора
4) не влияют на окраску индикатора
46. ПРИ ТИТРОВАНИИ СЛАБОГО ОСНОВАНИЯ (Кв=10-4) СИЛЬНОЙ КИСЛОТОЙ С ИНДИКАТОРОМ (рТ=5) ОШИБКА ВЫЗВАНА
1) несовпадением рТ индикатора с точкой нейтральности
2) изменением рТ индикатора в результате солевого эффекта
3) несовпадением рТ индикатора с рН в точке эквивалентности
47. ПРИ ТИТРОВАНИИ 0,1М РАСТВОРА NH3 0,1М РАСТВОРОМ НСl С ИНДИКАТОРОМ (рТ=4) ВОЗНИКАЕТ ОШИБКА
1) отрицательная
2) положительная
3) нет ошибки
48. НСl В ПРИСУТСТВИИ СН3СООН МОЖНО ОТТИТРОВАТЬ В РАСТВОРИТЕЛЕ
1) в этилендиамине
2) в ацетоне
3) в воде
4) в метаноле
49. ОСНОВАНИЕ (Кв=1·10-9) МОЖНО ОТТИТРОВАТЬ ХЛОРНОЙ КИСЛОТОЙ В РАСТВОРИТЕЛЕ
1) в ледяной уксусной кислоте
2) в этилендиамине
3) в воде
4) в метаноле
5) в этаноле
50. СН3СООNa МОЖНО ОТТИТРОВАТЬ СИЛЬНОЙ КИСЛОТОЙ В РАСТВОРИТЕЛЕ
1) в воде
2) в ледяной уксусной кислоте
3) в этилендиамине
4) в метаноле
5) в диметилформамиде
51. ЛЕДЯНАЯ УКСУСНАЯ КИСЛОТА НА СЛАБЫЕ ОСНОВАНИЯ ОКАЗЫВАЕТ ДЕЙСТВИЕ
1) усиливает диссоциацию
2) уменьшает диссоциацию
3) не оказывает никакого действия
52. ЭТИЛЕНДИТАМИН НА СМЕСЬ ВОДНЫХ РАСТВОРОВ НСl И СН3СООН ОКАЗЫВАЕТ ДЕЙСТВИЕ
1) нивелирует
2) растворяет
3) кислоты
53. ПРИ ТИТРОВАНИИ СМЕСИ Na2CO3
И NaOH РАСТВОРОМ
НСl С ФЕНОЛФТАЛЕИНОМ БУДЕТ ОТТИТРОВАНО
1) NaOH
2) NaOH+Na2CO3
3) Na2CO3
4) NaOH +половина Na2CO3
54. ОТТИТРОВАТЬ ЩАВЕЛЕВУЮ КИСЛОТУ РАСТВОРОМ СИЛЬНОГО ОСНОВАНИЯ С МЕТИЛОВЫМ ОРАНЖЕВЫМ МОЖНО
1) косвенным методом
2) прямым методом
3) нельзя
4) обратным методом
55. ОТТИТРОВАТЬ Н3РО4ПО ТРЕТЬЕЙ СТУПЕНИ МОЖНО
1) методом прямого титрования
2) методом замещения
3) методом обратного титрования
4) нельзя
56. СИЛЬНЫМИ КИСЛОТАМИ В ВОДНЫХ РАСТВОРАХ МОЖНО ОТТИТРОВАТЬ:
1) HCOONa
2) CH3COONa
3) Na2C4H4O6
4) Na2C2O4
5) Na2CO3
57. УСТРАНИМУЮ ЖЕСТКОСТЬ ВОДЫ МОЖНО ОПРЕДЕЛИТЬ СПОСОБОМ:
1) титрованием сильной кислотой с метиловым оранжевым
2) титрованием сильным основанием с фенолфталеином
3) титрованием трилоном Б
4) титрованием в присутствии адсорбционного индикатора
58. ВОДНЫЙ РАСТВОР ТЕТРАБОРАТА НАТРИЯ МОЖНО ТИТРОВАТЬ
1) NaOH
2) CH3COOH
3) HCI
4) NH3
5) CH3NH2
59. СКОЛЬКО СКАЧКОВ НА КРИВОЙ ТИТРОВАНИЯ РАСТВОРА ВИННОЙ КИСЛОТЫ РАСТВОРОМ NaOH СКАЧКОВ ТИТРОВАНИЯ БУДЕТ
1) два
2) один
3) три
4) ни одного
60. КРИВАЯ ТИТРОВАНИЯ КИСЛОТЫ НА ОСНОВАНИЕМ В СТРОИТСЯ В КООРДИНАТАХ
1) рН - V В, мл
2) [H+] - VВ, мл
3) [H+ ] -VНА, мл
4) рН - VНА, мл
5) рН - степень оттитрованности τ
61. КРИВАЯ ТИТРОВАНИЯ ОСНОВАНИЯ В СОЛЯНОЙ КИСЛОТОЙ СТРОИТСЯ В КООРДИНАТАХ
1) [OH- ] – V(HCl), мл
2) рН – V(HCl), мл 3) [H+ ] – V(3), мл
4) рН –V(B) - степень оттитрованности
5) pH – степень оттитрованности (τ)
62. ХОД КРИВОЙ ТИТРОВАНИЯ СЛАБОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ ЗА ТОЧКОЙ ЭКВИВАЛЕНТНОСТИ ЗАВИСИТ
1) от концентрации основания
2) от концентрации кислоты
3) от природы кислоты
4) от силы кислоты
63. ВЕЛИЧИНА СКАЧКА НА КРИВОЙ ТИТРОВАНИЯ СЛАБОЙ КИСЛОТЫ РАСТВОРОМ NAOH ЗАВИСИТ
1) от силы кислоты
2) от начального объема раствора
3) от температуры
4) от исходной концентрации кислоты
64. ПРИ ТИТРОВАНИИ МУРАВЬИНОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ ТОЧКА ЭКВИВАЛЕНТНОСТИ БУДЕТ СОВПАДАТЬ С ТОЧКОЙ НЕЙТРАЛЬНОСТИ
1) да
2) нет
3) точка нейтральности отсутствует
4) точка эквивалентности не наблюдается
65. ПРИ ТИТРОВАНИИ СЛАБОГО ОСНОВАНИЯ СИЛЬНОЙ КИСЛОТОЙ ЗНАЧЕНИЕ рН В ТОЧКЕ ЭКВИВАЛЕНТНОСТИ ОПРЕДЕЛЯЕТСЯ ПРЕИМУЩЕСТВЕННО ФАКТОРОМ
1) сила основания
2) объем основания
3) скорость титрования
4) исходная концентрация основания
66. ПРИ ТИТРОВАНИИ В ВОДНОМ РАСТВОРЕ ТОЧКА ЭКВИВАЛЕНТНОСТИ СОВПАДАЕТ С ТОЧКОЙ НЕЙТРАЛЬНОСТИ В СЛУЧАЕ
1) при титровании диэтиламина (С2Н5)2NH раствором HСl
2) при титровании СН3СООН раствором NaOH
3) при титровании НCl раствором NaOH
4) при титровании NH3раствором HСl
67. ВЕЛИЧИНА рН В ТОЧКЕ ЭКВИВАЛЕНТНОСТИ БОЛЬШЕ 7 В СЛУЧАЕ
1) титрования сильной кислоты сильным основанием
2) титрования слабой кислоты сильным основанием
3) титрования сильного основания слабой кислотой
4) титрования слабой кислоты слабым основанием
68. ПРИ ТИТРОВАНИИ В ВОДНЫХ РАСТВОРАХ ТОЧКА НЕЙТРАЛЬНОСТИ СОВПАДЕТ С ТОЧКОЙ ЭКВИВАЛЕНТНОСТИ В СЛУЧАЕ
1) титрования слабой кислоты сильным основанием
2) титрования слабого основания сильной кислотой
3) титрования сильной кислоты сильным основанием
4) титрования сильного основания слабой кислотой
5) титрования сильной кислоты слабым основанием
69. ВЕЛИЧИНА рН В ТОЧКЕ ЭКВИВАЛЕНТНОСТИ МЕНЬШЕ 7 В СЛУЧАЕ
1) титрования сильной кислоты сильным основанием
2) титрования слабой кислоты сильным основанием
3) титрования слабого основания сильной кислотой
4) титрования сильного основания сильной кислотой
70. НА КРИВОЙ ТИТРОВАНИЯ ТЕТРАБОРАТА НАТРИЯ СОЛЯНОЙ КИСЛОТОЙ БУДЕТ СКАЧКОВ ТИТРОВАНИЯ
1) ни одного
2) один
3) два
4) три
71. КРИВАЯ ТИТРОВАНИЯ ОКСАЛАТА НАТРИЯ РАСТВОРОМ НСl ХАРАКТЕРИЗУЕТСЯ НАЛИЧИЕМ СКАЧКА
1) ни одного
2) один
3) два
72. НА КРИВОЙ ТИТРОВАНИЯ РАСТВОРА Н2SO4NaOH БУДЕТ СКАЧКОВ
1) два
2) один
3) три
4) ни одного
РАСТВОРОМ
73. В КАЧЕСТВЕ ПЕРВИЧНОГО СТАНДАРТА ДЛЯ СТАНДАРТИЗАЦИИ РАСТВОРА NaOH ВЫБРАНА ЩАВЕЛЕВАЯ КИСЛОТА. НА КРИВОЙ ТИТРОВАНИЯ РАСТВОРА NaOH ЩАВЕЛЕВОЙ КИСЛОТОЙ БУДЕТ СКАЧКОВ
1) два
2) один
3) три
4) ни одного
74. ОСОБЕННОЕ ЗНАЧЕНИЕ В КОМПЛЕКСОМЕТРИЧЕСКОМ ТИТРОВАНИИ ИМЕЮТ
1) монодентатные лиганды
2) полидентатные лиганды
3) однозарядные ионы, участвующие в комплексообразовании
4) многозарядные ионы металлов
75. В КОМПЛЕКСОНОМЕТРИИ НАИБОЛЕЕ ЧАСТО ИСПОЛЬЗУЮТ
1) ЭДТА
2) ДМГ
3) тиомочевину
4) 8-оксихинолин
76. ВЫСОКАЯ УСТОЙЧИВОСТЬ ЭТИЛЕНДИАМИНТЕТРАУКСУСНОЙ КИСЛОТЫ ОБУСЛОВЛЕНА
1) наличием устойчивых фосфоновых групп
2) возможностью образования несимметричной структуры высокого напряжения
3) наличием функциональных групп с донорными атомами азота и кислорода
4) наличием активных протонов
77. КРИВЫЕ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ СТРОЯТ В КООРДИНАТАХ
1) f(pH)
3) f(pKa)
2) pH(f)
4) pM(f)
78. РАВНОВЕСНАЯ КОНЦЕНТРАЦИЯ КОМПЛЕКСА В ТОЧКЕ ЭКВИВАЛЕНТНОСТИ, КОГДА ВСЕ ИОНЫ МЕТАЛЛА ВОШЛИ В КОМПЛЕКС MY(n-4)+РАВНА (С УЧЁТОМ РАЗБАВЛЕНИЯ)
1) [MY ] = C
0,M V
V0,M
 + V
+ V
2) [MY ] = C
0,M Y
V0,M

|
Y
3) [MY ] = (C
0,M
+ C0,Y )
V
V0,M
 + V
+ V
4) [MY ]
= C0,M
V0,M V1,M
0,M Y
+ V0,Y
 + V1,Y
+ V1,Y
Fe2+
79. УСЛОВНАЯ КОНСТАНТА УСТОЙЧИВОСТИ КОМПЛЕКСА С АНИОНОВ ЭТИЛЕНДИАМИНТЕТРАУКСУСНОЙ КИСЛОТЫ
ПРИ pH=2
1) 2,8·1011
2) 2,34·106
3) 1,6
4) 45
80. ПРИ ВИЗУАЛЬНОМ ОПРЕДЕЛЕНИИ КОНЕЧНОЙ ТОЧКИ ТИТРОВАНИЯ В КОМПЛЕКСОНОМЕТРИЧЕСКОМ ТИТРОВАНИИ ИСПОЛЬЗУЮТ ИНДИКАТОРЫ
1) кислотно-основные
2) металлоиндикаторы
3) флуоресцирующие индикаторы
4) не используют индикаторы
81. ПОГРЕШНОСТЬ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ РАВНА
1) ПТ ,% = ( f
é 1
 - 1)100 = ê '
- 1)100 = ê '
' ù

|
êë b MY C0,M úû
é C ' ù
2) ПТ ,% = ( f
- 1)100 = ê
M ú100
 êëC0,M úû
êëC0,M úû
é ' ù
3) ПТ ,% = ( f
 - 1)100 = ê ' '
- 1)100 = ê ' '
- CM
ú100
 êëCM b MY
êëCM b MY
C0,M úû
4) ПТ ,% = ( f
é 1
 - 1)100 = ê '
- 1)100 = ê '
1 ' ù

|
êëCM
2 C0,M úû
Fe2+
82. УСЛОВНАЯ КОНСТАНТА УСТОЙЧИВОСТИ КОМПЛЕКСА С АНИОНОВ ЭТИЛЕНДИАМИНТЕТРАУКСУСНОЙ КИСЛОТЫ
ПРИ pH=2
1) 2,8·1011
2) 2,34·106
3) 1,6
4) 45
83. К ФУНДАМЕНТАЛЬНЫМ ФАКТОРАМ, ВЛИЯЮЩИМ НА УСТОЙЧИВОСТЬ КОМПЛЕКСОВ, НЕ ОТНОСИТСЯ
1) природа центрального и донорного атома
2) хелатный эффект
3) стерический эффект
4) внешние условия (t, природа растворителя, ионная сила, состав раствора)
84. ОГРАНИЧЕННОЕ ИСПОЛЬЗОВАНИЕ ОСАДИТЕЛЬНЫХ МЕТОДОВ ТИТРОВАНИЯ СВЯЗАНО С
1) трудностью отделения осадка от раствора
2) неколичественное и нестехиометрическое протекание
реакций
3) влияние электростатических явлений на конечную точку
титрования
4) сложности в методах фиксирования точки эквивалентости
85. В МЕТОДАХ ОСАДИТЕЛЬНОГО ТИТРОВАНИЯ КРИВЫЕ ЛОГИЧНО СТРОИТЬ В КООРДИНАТАХ
1) pH(f)
 3) EOxRed ( f )
3) EOxRed ( f )
2) pM(f)
4) p[A](f)
86. СИММЕТРИЧНОСТЬ ЛОГАРИФМИЧЕСКИХ КРИВЫХ ОСАДИТЕЛЬНОГО ТИТРОВАНИЯ ОПРЕДЕЛЯЕТСЯ
1) протеканием ступенчатого осаждения
2) монотонностью изменения потенциала на поверхности
осадка
3) стехиометрией осадка
4) скоростью осаждения вещества
87. ДО ТЭ КОНЦЕНТРАЦИЯ ОСАЖДАЕМОГО ИОНА ОПРЕДЕЛЯЕТСЯ ФОРМУЛОЙ
1) pГ = -lg C0- lg(1 - f )
2)  pГ = 1 2 pK S
pГ = 1 2 pK S
3) pГ = pK S + lg CT+ lg( f
4) pГ = pK S - lg C0
- 1)
88. ВЕЛИЧИНА СКАЧКА ТИТРОВАНИЯ ОПРЕДЕЛЯЕТСЯ
1) исходной концентрацией и температурой раствора
2) кислотностью среды и произведением растворимости
осадка
3) исходной концентрацией и произведением растворимости
4) концентрацией титранта и скоростью его подачи
89. ДЛЯ ОПРЕДЕЛЕНИЯ КТТ ПО МЕТОДУ МОРА В КАЧЕСТВЕ ИНДИКАТОРА ИСПОЛЬЗУЮТ
1) тиоцианат-ион
2) арсенат-ион
3) адсорбционные индикаторы
4) хромат-ион
90. К СПОСОБАМ ОБНАРУЖЕНИЯ КОНЕЧНОЙ ТОЧКИ ОСАДИТЕЛЬНОГО ТИТРОВАНИЯ НЕ ОТНОСИТСЯ
1) метод Фольгарда
2) метод Пашена
3) метод Фаянса
4) метод Гей-Люссака
91. ИЗ ВСЕХ ОСАДИТЕЛЬНЫХ МЕТОДОВ НАИБОЛЕЕ ШИРОКО ИСПОЛЬЗУЮТ
1) аргентометрию
2) меркурометрию
3) арсенометрию
4) перманганатометрию
92. СИСТЕМАТИЧЕСКАЯ ПОГРЕШНОСТЬ ТИТРОВАНИЯ СВЯЗАНА С
1) точностью приготовления раствора титранта
2) несовпадением ТЭ и КТТ
3) адсорбционными явлениями на поверхности осаждаемой
формы
4) с крутизной кривой титрования
93. НЕОБХОДИМЫМ УСЛОВИЕМ РАЗДЕЛЬНОГО ТИТРОВАНИЯ ИОНОВ, ОБРАЗУЮЩИХ МАЛОРАСТВОРИМЫЕ СОЕДИНЕНИЯ С ТИТРАНТОМ ЯВЛЯЕТСЯ
1) различные скорости осаждения
2) различие в окраске конечных форм
3) значительное различие в произведении растворимости
4) различная константа устойчивости
