Комплексонометрическое титрование
В аналитической химии широко применяется метод анализа, основанный на использовании реакций, сопровождающихся образованием внутрикомплексных (хелатных) соединений с органическими соединениями - комплексонами. Комплексонами называют аминополикарбоновые кислоты и их производные. В анализе используют ее динатриевую соль Na2H2L×2Н2О, которая в отличие от кислоты хорошо растворима в воде и находит более широкое применение:

Комплексоны являются полидентатными лигандами, которые образуют со многими катионами (Са2+, Ва2+, Sr2+, Mg2+, Со2+, Сu2+, Bi3+, Al3+, Zn2+, Fe3+, Ni2+ и др.) очень прочные, хорошо растворимые в воде, бесцветные внутрикомплексные (хелатные) соединения.
Внутрикомплексные соли образуются всегда в тех случаях, когда катионы металла – комплексообразователя замещают активные атомы водорода функциональных групп органического соединения, а также с определенными его группами образуют координационные (донорно-акцепторные) связи. К группам, в которых атомы водорода способны замещаться на ионы металла, относятся СООН, -SО3Н, -ОН, =NOH и др.
Донорно-акцепторную связь с ионами комплексообразователя способны образовывать группы −NH2, =NH, −NOH, =S, =СО и др.
Комплексонометрия (трилонометрия) – титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота.
Во всех случаях независимо от степени окисления катионов они реагируют с комплексоном в соотношении 1: 1, поэтому фактор эквивалентности для ЭДТА и катионов металла равен 1.
Схематически реакции комплексообразования с катионами, имеющими различные степени окисления, можно представить следующими уравнениями:
H2L2- + Ме2+ ↔ [MeL]2- + 2Н+
H2L2- + Ме3+ ↔ [MeL]- + 2Н+
H2L2- + Ме4+ ↔ [MeL] + 2Н+
В качестве титранта используют растворы 0,1; 0,05 или 0,02 моль/дм3 трилона Б.
Способы фиксирования конечной точки титрования. При комплексонометрическом титровании используют металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы - это органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б, цинкон и др.), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б.
При этом комплекс катиона с индикатором и свободный индикатор имеют различную окраску:
H2Ind- + Ме 2+ ↔ [Ме Ind]-
(окраска 1) (окраска 2)
При комплексонометрическом титровании к анализируемому раствору прибавляют металлоиндикатор, который образует с определяемыми катионами комплекс, имеющий определенную окраску. В процессе титрования трилоном Б комплекс катионов металла с индикатором разрушается и образуется бесцветный, очень прочный комплекс катионов с трилоном Б, а в раствор переходят ионы свободного индикатора:
[Ме Ind] - + H2L2 - ↔ [MeL]2 - + H2Ind -
(окраска 2) (окраска 1)
Конечную точку титрования определяют по собственной окраске индикатора (окраска 1).
Металлоиндикаторы в водном растворе, неустойчивы. Поэтому их применяют в виде сухих смесей, тщательно растирая в фарфоровой ступке индикатор с сухими, химически чистыми NaCl или КСl в соотношении 1 : 100 . или 1 : 200. Для титрования берут сухой стеклянной ложечкой 20-30 мг этой смеси на 100 мл титруемого раствора.
Условия комплексонометрическоro титрования:
1. Реакции комплексообразования должны протекать быстро, количественно и стехиометрично, чтобы вблизи точки эквивалентности определяемые катионы были практически полностью связаны в комплекс. Константа нестойкости образующихся комплексов должна быть малой величиной.
2. Определяемые ионы должны образовывать с металлоиндиктором менее прочные комплексы, чем их комплексы с трилоном Б.
3. Комплексонометрическое титрование следует проводить при определенном значении рН (рН < 10), так как в щелочной среде могут образовываться осадки гидроксидов определяемых катионов или их основные соли.
В процессе титрования при взаимодействии катионов с трилоном Б в раствор переходят ионы Н+, в результате чего рН раствора понижается, что приводит к смешению реакции комплексообразования влево и делает реакцию обратимой. Для поддержания определенного значения рН титрование следует проводить в присутствии буферных растворов, имеющих определенное значение рН. Большинство катионов титруют трилоном Б в присутствии аммиачного буферного раствора NH4ОH + NH4Cl при рН = 9,2.
Очень прочные комплексы с комплексоном III образуют катионы Fe3+, Sn2+ и другие, их можно определить в кислой среде. Катионы, образующие менее прочные комплексы с трилоном Б, не мешают определению, так как не титруются в кислой среде.
Способы комплексонометрического титрования.
1. Прямое титрование. К анализируемому раствору прибавляют аммиачный буферный раствор, металлоиндикатор и титруют стандартным раствором трилона Б. Способом прямого титрования определяют катионы Cu2+, Со2+, Pb2+, Ni2+, Zn2+, Fе3+, Ва2+, Сг3+,Ca2+, Mg2+ и т. д.
2. Обратное титрование. К анализируемому раствору прибавляют аммиачный буферный раствор, затем точно отмеренный удвоенный минимальный объем (35,00-40,00 см3) стандартного раствора трилона Б, который вступает в реакцию с определяемыми ионами, а его избыток оттитровывают стандартным раствором магния сульфата или цинка сульфата в присутствии металлоиндикатора. При этом протекают реакции:
Ме2+ + H2L2- ↔ [Ме]2- + 2Н+
изб. H2L2- + Zn2+ ↔ [ZnL] 2- + 2Н+
Способ обратного титрования применяют:
− когда реакция комплексообразования протекает медленно;
− нет подходящего индикатора для фиксирования конечной точки титрования при прямом способе титрования;
− индикатор образует с определяемым ионом очень прочный комплекс, который не разрушается комплексоном;
− для определения катионов в нерастворимых в воде осадках например Са2+ в СаС2О4; Mg2+ в MgNH4PО4; Рb2+ в PbSО4.
3. Заместительное титрование. Метод основан на том, что большинство ионов образуют с трилоном Б более устойчивые комплексные соединения, чем комплекс катионов Mg2+ с трилоном Б [MgL] 2- (β = 9,72). После прибавления к анализируемому раствору комплекса [MgL] 2- протекает реакция обмена:
[MgL] 2- + Ме2+ → [MeL] 2- + Mg2+
Эта реакция возможна потому, что ионы металла образуют с H2L2- более прочное комплексное соединение [MeL]2- (β > 9,2), и равновесие вышеприведенной реакции смещается вправо. Выделившиеся ионы Mg2+ оттитровывают стандартным раствором трилона Б в присутствии металлохромного индикатора:
Mg2+ + H2L2- → [MgL] 2- + 2Н+
Трилонометрическим методом определяют:
а) общую жесткость воды;
б) практически все катионы щелочноземельных и тяжелых металлов;
в) в фармацевтическом анализе – лекарственные формы, содержащие катионы щелочноземельных металлов.
Лабораторная работа № 13
Комплексонометрическое определение общей жесткости воды
Цель работы:определение общей жесткости воды, то есть общее содержание в ней солей кальция и магния.
Ход работы
Определение содержания ионов Ca2+ и Mg2+.
Получить у преподавателя контрольный раствор в мерную колбу на 100 мл. Разбавить раствор водой до метки, закройте пробкой и тщательно перемешайте. Отмерьте пипеткой 20 (25) мл полученного раствора в коническую колбу для титрования. Разбавьте дистиллированной водой до 50-70 мл, прибавьте 5 мл аммонийной буферной смеси и около 20 мг индикатора ЭХЧ – Т. Оттитруйте комплексоном III до перехода винно-красной окраски в синюю с зеленоватым оттенком. Повторите титрование 2-3 раза.
Вычислите средний объем комплексона III, пошедший на титрование, и вычислите результат, то есть количество эквивалентов Ca2+ (Mg2+) в 100 мл раствора:
n (  Ca2+) = С (
Ca2+) = С (  трилон Б) ∙ V (трилон Б) ∙
трилон Б) ∙ V (трилон Б) ∙ 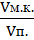 ,
,
где n – количество эквивалентов Ca2+ и Mg2+,
С (трилон Б) – концентрация комплексона III, моль/л,
V (трилон Б) – объем рабочего раствора, измеренного по бюретке, мл,
Vм.к. – объем мерной колбы (100 мл),
Vп. – объем пипетки, мл.
Контрольные вопросы:
1. На чем основан метод комплексонометрии?
2. Какое соединение в комплексонометрии обозначают через ЭДТА?
3. Что такое металлоиндикаторы? На чем основано их применение?
4. Что такое общая жесткость воды? В каких единицах она измеряется?
5. В чем сущность комплексонометрического метода определения общей жесткости воды?
6. Чему равна общая жесткость воды, если на титрование 100,00 мл ее израсходовано 25,50 мл 0, 1022 н. раствора трилона Б?
Тема 14
