Комплексонометрическое титрование
Комплексонометрическое титрование (или комплексонометрия) основано на образовании прочных комплексных соединений хелатного типа ионов металлов со специальными органическими реагентами группы аминополикарбоновых кислот — комплексонами. Среди комплексонов наибольшее практическое значение имеет этилендиаминтетрауксусная кислота (ЭДТУ, комплексон II, Трилон А), а также ее натриевая соль.
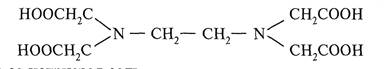
Внутрикомплексные (хелатные) соединения с ЭДТУ образуются за счет, с одной стороны, замещения ионами металла-комплесообразователя активных атомов водорода карбоксильных групп, а с другой — взаимодействия с атомами азота, в результате образования донорно-акцепторных связей. При взаимодействии с ионами металлов ЭДТУ образует комплексные соединения постоянного состава 1:1 независимо от заряда катиона, что является ценным свойством ЭДТУ как титранта.
Выделяющиеся при реакции ионы водорода сдвигают равновесие реакции образования комплекса влево, поэтому для полноты протекания реакции титрование проводят в буферных растворах при постоянном и подходящем значении рН.
Так, для титрования катионов, образующих малоустойчивые комплексы (ионы Са2+, Mg2+), требуется слабощелочная среда. Наоборот, титрование катионов, образующих более устойчивые комплексы (ионы Zn2+, Ni2+), можно успешно провести в умеренно кислой среде (рН = 4-5).
На практике обычно применяют не ЭДТУ, ввиду ее малой растворимости, а динатриевую соль этилендиаминтетрауксусной кислоты Na2H2Y (ЭДТА, комплексон III,Трилон Б). Дигидрат ЭДТА, относительно хорошо растворим в воде, его молярная масса 372,25 г/моль. Точную концентрацию трилона Б устанавливают по стандартным растворам солей цинка (П), меди(П) или магния. Растворы цинка и меди готовят растворением соответствующих металлов в кислотах.
Комплексы, образуемые ЭДТА с большинством катионов металлов, весьма устойчивы. Это обеспечивает практически полное связывание определяемого металла в комплекс при титровании. Большой интерес вызывает их способность давать комплексы с ионами щелочноземельных металлов: магнием, кальцием, барием, которые, как известно, трудно или невозможно перевести в комплексные соединения, используя другие реагенты.
Способы титрования. Комплексонометрическое титрование можно проводить методом прямого, обратного и вытеснительного титрования.
Метод прямого титрования реализуют при определенном рН стандартным раствором ЭДТА. Конечную точку титрования устанавливают с помощью индикаторов.
Метод обратного титрования часто используют, если для катиона металла невозможно подобрать индикатор. К анализируемому раствору прибавляют измеренный объем стандартного раствора ЭДТА, избыток которого оттитровывают стандартным раствором соли магния или цинка в присутствии металлоиндикатора, реагирующего с ионами магния или цинка.
Индикаторы комплексонометрии.Для титрования с помощью ЭДТА используют металлоиндикаторы.Металлоиндикаторы — это красители, обладающие комплексообразующими и, как правило, кислотно-основными свойствами. При этом необходимо, чтобы различные формы красителя обладали разной окраской. Окраска комплекса MeInd отличается окраски свободного индикатора HInd. Вследствие этого в процессе титрования индикатор выделяется в свободном виде, что вызывает изменение окраски титруемого раствора, особенно заметное в конечной точке титрования.
Примером такого индикатора служит эриохром черный Т -органическое соединение, способное в нейтральной или щелочной среде (рН = 7 ... 11) образовывать комплексы с ионами металлов (Са2+, Mg2+, Zn2+, Mn2+, Al3+ и др.). Раствор несвязанного и комплекс индикатора окрашен в синий цвет, комплекс металл индикатор MeInd — в красный. При титровании раствором ЭДТА окраска раствора из красной превращается в синюю при завершении титрования.
Практическое применение.При помощи ЭДТА и аналогичных лигандов можно титриметрически определять около 30 элементов.Этот метод необходим для определения в живых организмах Са и Mg. В биологии и медицине комплексоны используют как стабилизаторы при хранении крови, т.к. они связывают ионы металлов, катализирующие реакции окисления. Так же многие лекарственные препараты в целях стабилизации содержат ЭДТУ. При профессиональных заболеваниях с помощью комплексонов из организма выводят ионы токсичных металлов.
Практически важным является совместное титриметрическое определение кальция и магния для характеристики общей жесткости воды, которая определяется наличием ионов кальция и магния. В норме она составляет5,6 ммоль/л.
