Данные опыта и результаты расчетов. Номер титрования V (HCl) (объем кислоты) V (NaOH) (объем щелочи) Vср (NaOH)
| Номер титрования | V (HCl) (объем кислоты) | V (NaOH) (объем щелочи) | Vср (NaOH) (среднее значение объема щелочи) |
Вычислить:
1. Молярную концентрацию эквивалентов раствора кислоты по закону эквивалентов:
сэк (HCl)∙V(HCl) = сэк (NaOH)∙V (NaOH),
откуда 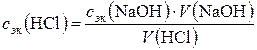 , моль/л,
, моль/л,
где сэк (HCl) и сэк (NaOH) – молярные концентрации эквивалентов растворов; V (HCl) и V (NaOH) – объемы реагирующих растворов.
2. Титр раствора НСl по формуле
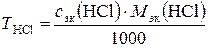 , г/мл.
, г/мл.
Примеры решения задач
Пример 7.1. Водный раствор содержит 354 г H3PO4 в 1 л. Плотность раствора ρ = 1,18 г/мл. Вычислить: а) массовую долю (%) H3PO4 в растворе; б) молярную концентрацию; в) молярную концентрацию эквивалентов; г) моляльность;
д) титр; е) молярные доли H3PO4 и Н2О.
Решение. а). Для расчета массовой доли воспользуемся формулой
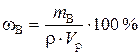 ;
; 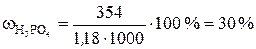 .
.
б). Молярная концентрация вещества В или молярность(сВ или М) – отношение количества растворенного вещества к объему раствора:
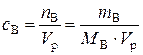 , моль/л, (1)
, моль/л, (1)
где nB – количество вещества В, моль; mB – масса вещества В, г; МВ– молярная масса вещества В, г/моль; Vр– объем раствора, л.
Молярная масса H3PO4 равна 98 г/моль. Молярную концентрацию раствора находим из соотношения (1):
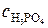 =
= 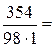 3,61 моль/л.
3,61 моль/л.
в). Молярную концентрацию эквивалентов рассчитываем по формуле 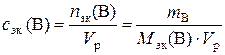 . Молярная масса эквивалентов H3PO4 равна
. Молярная масса эквивалентов H3PO4 равна 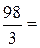 32,7 г/моль.
32,7 г/моль. 
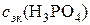 =
= 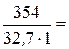 10,83 моль/л.
10,83 моль/л.
г). Моляльная концентрация вещества В или моляльность(сm(B)) – отношение количества растворенного вещества к массе растворителя:
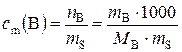 , моль/кг, (2)
, моль/кг, (2)
где nВ – количество вещества В, моль; mB – масса вещества В,г; mS – масса растворителя, г; МВ − молярная масса вещества В, г/моль.
Для определения моляльности по формуле (2) необходимо рассчитать массу растворителя в растворе. Масса раствора составляет 1,18∙1000 = 1180 г.
Масса растворителя в растворе mS = 1180 – 354 = 826 г.
Моляльная концентрация раствора равна
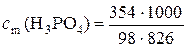 = 4,37 моль/кг.
= 4,37 моль/кг.
д). Титр раствора можно рассчитать по формулам:
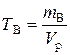 ;
; 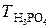 =
= 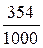 = 0,354 г/мл,
= 0,354 г/мл,
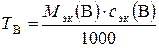 ;
; 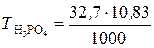 = 0,354 г/мл,
= 0,354 г/мл,
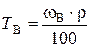 ;
; 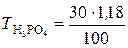 = 0,354 г/мл.
= 0,354 г/мл.
е). Молярная (мольная) доля вещества В(хВ), безразмерная величина – отношение количества данного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель.
Если раствор состоит из одного растворенного вещества и растворителя, то молярная доля вещества (хВ) равна
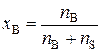 , (3)
, (3)
а молярная доля растворителя (xS)
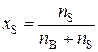 , (4)
, (4)
где nB – количество растворенного вещества, моль; nS – количество вещества растворителя, моль.
Сумма молярных долей всех веществ раствора равна единице.
В 1 л раствора содержится 3,61 моль H3PO4 (см. пункт б). Масса растворителя в растворе 826 г, что составляет 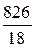 = 45,9 моль.
= 45,9 моль.
Молярные доли H3PO4 и Н2О рассчитываем по формулам (3) и (4):
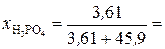 0,073;
0,073;
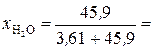 0,927.
0,927.
Пример 7.2. Сколько миллилитров 50 %-го раствора HNO3, плотность которого 1,32 г/мл, требуется для приготовления 5 л 2 %-го раствора, плотность которого 1,01 г/мл?
Решение. При решении задачи пользуемся формулой
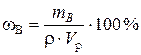 .
.
Сначала находим массу азотной кислоты в 5 л 2 %-го раствора:
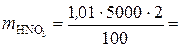 101 г.
101 г.
Чтобы ответить на вопрос задачи, надо определить, в каком объеме раствора с массовой долей HNO3 50 % содержится 101 г HNO3:
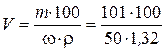 = 153 мл.
= 153 мл.
Таким образом, для приготовления 5 л 2 %-го раствора HNO3 требуется 153 мл 50 %-ного раствора HNO3.
Пример 7.3. На нейтрализацию 50 мл раствора  кислоты израсходовано 25 мл 0,5 н. раствора щелочи. Чему равна нормальность кислоты?
кислоты израсходовано 25 мл 0,5 н. раствора щелочи. Чему равна нормальность кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то можно написать
VA∙н. (А) = VB∙н. (B);
50∙н. (кислоты) = 25∙0,5, отсюда
н. (кислоты) = 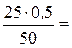 0,25 н..
0,25 н..
Следовательно, для реакции был использован 0,25 н. раствор кислоты.
