Гальванический элемент
Примеры решения задач
Гальванические элементы – это устройство, в которых происходит самопроизвольно переход химической энергии окислительно – восстановительной реакции в электрическую энергию.
Он представляет собой два металлических электрода, опущенные в растворы собственных солей, которые соединены между собой полупроницаемой перегородкой. При замыкании внешней цепи через измерительный прибор, последний покажет напряжение между электродами.
Электрод – это система: металл – раствор электролита. При погружении металла в раствор собственных ионов начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной реакцией, протекающей на электроде, является взаимодействие поверхностных ион –атомов металла, находящихся в узлах кристаллической решетки, с полярными молекулами воды, ориентированными у поверхности электрода. В результате взаимодействия гидратированные ионы металла переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами металла. В результате этого металл становится заряженным отрицательно, а раствор – положительно.
Между металлом и раствором возникает разность потенциалов, получившая название электродного потенциала. При некотором определенном значении электродного потенциала устанавливается равновесие:
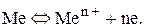 (1)
(1)
Данное равновесие характерно для металлического электрода, полученного погружением металла в раствор своей соли.
Помимо металлических электродов существуют и газовые электроды, в которых металл не принимает участия в образовании двойного электрического слоя, а играет роль токоотвода.
В газовых электродах в образовании потенциала принимает участие газ и его ионы из раствора электролита.
Так для водородного электрода при некотором значении электродного потенциала устанавливается равновесие между молекулами и ионами водорода:
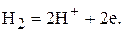 (2)
(2)
Для кислородного электрода при некотором значении электродного потенциала устанавливается равновесие между молекулами кислорода и ионами гидроксила:
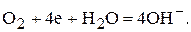 (3)
(3)
Ионы 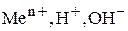 и называются потенциалопределяющими для металлического, водородного, кислородного электродов соответственно.
и называются потенциалопределяющими для металлического, водородного, кислородного электродов соответственно.
Величина электродного потенциала металлических электродов определяется природой металла, температурой, концентрацией ионов металла в растворе и давлением (для газовых электродов).
Стандартный электродный потенциал, 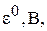 – это потенциал, который устанавливается на электроде при стандартных условиях: температура
– это потенциал, который устанавливается на электроде при стандартных условиях: температура 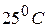 и концентрации потенциалопределяющих ионов 1 моль/л, давление 101,3 кПа (для газовых электродов). Значения стандартных электродных потенциалов приведены в приложении.
и концентрации потенциалопределяющих ионов 1 моль/л, давление 101,3 кПа (для газовых электродов). Значения стандартных электродных потенциалов приведены в приложении.
Равновесный электродный потенциал, 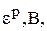 – это потенциал, который возникает на электроде при данных условиях, которые могут отличаться от стандартных.
– это потенциал, который возникает на электроде при данных условиях, которые могут отличаться от стандартных.
Зависимость величины электродного потенциала металлического электрода от активной концентрации потенциалопределяющих ионов при 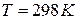 выражается уравнением Нернста.
выражается уравнением Нернста.
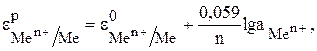 (4)
(4)
где 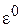 – стандартный электродный потенциал,
– стандартный электродный потенциал, 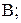

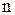 – число электронов, участвующих в электродной реакции;
– число электронов, участвующих в электродной реакции; 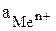 активная концентрация потенциалопределяющих ионов, моль/л.
активная концентрация потенциалопределяющих ионов, моль/л.
Для водородного и кислородного электродов их равновесные потенциалы можно рассчитать по уравнениям (5),(6) соответственно:
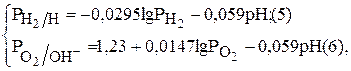
где 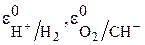 – стандартные электродные потенциалы водородного и кислородного электродов;
– стандартные электродные потенциалы водородного и кислородного электродов; 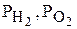 – парциальные давления водорода и кислорода;
– парциальные давления водорода и кислорода; 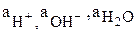 – активности в растворе ионов водорода, гидроксила и воды, моль/л.
– активности в растворе ионов водорода, гидроксила и воды, моль/л.
В гальванических элементах при разомкнутой цепи на электродах устанавливается равновесие, характеризуемое величиной равновесного электродного потенциала. При замыкании цепи равновесие на электродах нарушается и на электроде, потенциал которого более отрицателен, пойдет процесс окисления, а на другом электроде, потенциал которого более положителен,– процесс присоединения электронов – восстановление. Электрод, на котором идет окисление, называют анодом: этот электрод имеет знак минус. Электрод, на котором идет восстановление, называют катодом; он имеет знак плюс.
Важнейшей характеристикой гальванических элементов является электродвижущаяся сила – E (ЭДС). ЭДС – это максимальная разность потенциалов, которая устанавливается на электродах при разомкнутой цепи
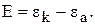 (7)
(7)
В работающем гальваническом элементе измеряют не ЭДС, ф напряжение – U. Напряжение гальванического элемента всегда меньше ЭДС из-за омических потерь и поляризации гальванического элемента, 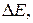 которая равна сумме катодной и анодной поляризаций.
которая равна сумме катодной и анодной поляризаций.
Электродвижущую силу гальванического элемента, кроме формулы (7) можно рассчитать по уравнению (8), если известны активности потенциалопределяющих ионов восстановителя и окислителя:
E = E0+(0,059/n)×(lg a (окисл)/ lg a (восст)) (5)
где 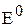 – стандартная ЭДС гальванического элемента;
– стандартная ЭДС гальванического элемента; 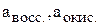 – активные концентрации восстановителя и окислителя.
– активные концентрации восстановителя и окислителя.
Значение ЭДС можно вычислить по уравнению (6), если известны термодинамические характеристики токообразующей реакции:
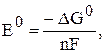 (9)
(9)
где 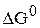 – стандартное значение энергии Гиббса токообразующей реакции, кДж/моль;
– стандартное значение энергии Гиббса токообразующей реакции, кДж/моль; 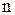 – число электронов, участвующих в электрохимическом процессе;
– число электронов, участвующих в электрохимическом процессе; 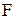 – число Фарадея, равное 96500 Дж/(моль×В).
– число Фарадея, равное 96500 Дж/(моль×В).
Изменение энергии Гиббса для любой химической реакции, в том числе и электрохимической, рассчитывают по следствию из закона Гесса, как разность между стандартной энергией Гиббса продуктов реакции и энергией Гиббса исходных веществ.
