Тема «Гальванический элемент»
Рассмотреть работу гальванического элемента по плану:
1. Определите потенциалы электродов гальванического элемента.
2. Установите анод и катод. Запишите процессы, протекающие на аноде и катоде.
3. Сделайте условную графическую запись гальванического элемента, укажите в ней заряды электродов, направление движения электронов и ионов.
4. Определите ЭДС гальванического элемента.
| № варианта | Схема гальванического элемента | Концентрация электролита |
| Cu/CuCl2||CdCl2/Cd | CCu2+=0.1 M, CCd2+=0,002 M | |
| Ag/AgNO3||Zn(NO3)2/Zn | CAg+=0,2M, CZn2+=0,001M | |
| Pb/Pb(NO3)2||Mg(NO3)2/Mg | CPb2+=0,1 M, CMg2+=10-4 M | |
| Al/Al2(SO4)3||SnSO4.Sn | CAl3+0,01 M, CSn2+=0,5 M | |
| Fe/FeCl2||CoCl2/Co | CFe2+=0,2 M, CCo2+=0,001 M | |
| Ni/NiSO4||CuSO4/Cu | CNi2+=0,0001M, CCu2+=0,5M | |
| Ag/AgNO3||Cd(NO3)2/Cd | CAg+=0,1 M, CCd2+=0,002M | |
| Sn/Sn(NO3)2||Zn(NO3)2/Zn | CSn2+=0,0005 M, CZn2+=0,1 M | |
| Pb/Pb(NO3)2||Fe(NO3)2/Fe | CPb2+=0,005 M, CFe2+=0,2 M | |
| Cu/CuSO4||CoSO4/Co | CCu2+=2 M, CCo2+=10-3 M | |
| Ag/AgNO3||Ni(NO3)2/Ni | CAg+=0,001 M, CNi2+=0,5 M | |
| Sn/SnCl2||CoCl2/Co | CSn2+=0,1 M, CCo2+=0,005 M | |
| Pb/Pb(NO3)2||Cd(NO3)2/Cd | CPb2+=0,01 M, CCd2+=0,5 M | |
| Al/Al2(SO4)3||H2SO4/H2(Pt) | CAl3+=0,2 M, pH=2 | |
| Cu/CuCl2||MgCl2/Mg | CCu2+=0,001 M, CMg2+=2 M | |
| Zn/ZnCl2||AuCl3/Au | CZn2+=0,5 M, CAu3+=0,0001 M | |
| Ag/AgNO3||Fe(NO3)2/Fe | CAg+=0,0001 M, CFe2+=2 M | |
| Pb/Pb(NO3)2||Ni(NO3)2/Ni | CPb2+=0,1 M, CNi2+=0,001 M | |
| Sn/SnSO4||MgSO4/Mg | CSn2+=0,5 M, CMg2+=0,01 M | |
| Cu/CuCl2||ZnCl2/Zn | CCu2+=2 M, CZn2+=10-4 M | |
| Ag/AgNO3||Co(NO3)2/Co | CAg+=0,5 M, CCo2+=0,001 M | |
| Al/Al2(SO4)3||Au2(SO4)3/Au | CAl3+=10-4 M, CAu3+=2 M | |
| Pt/PtCl2||HCl/H2(Pt) | CPt2+=0,5 M, pH=1,5 M | |
| Sn/SnCl2||Pb(NO3)2/Pb | CSn2+=10-5 M, CPb2+=0,5 M | |
| Co/CoSO4||ZnSO4/Zn | CCo2+=0,2 M, CZn2+=0,001 M | |
| Ag/AgNO3||HNO3/H2(Pt) | CAg+=2 M, pH=1 | |
| (Pt)H2/H2SO4||H2SO4/H2(Pt) | pH=2,5, pH=3,5 | |
| Ag/AgNO3||Mg(NO3)2/Mg | CAg+=0,1 M, CMg2+=0,5 M | |
| Zn/ZnSO4||H2SO4/H2(Pt) | CZn2+=0,2 M, pH=3 | |
| Sn/SnCl2||FeCl2/Fe | CSn2+=0,01 M, CFe2+=0,05 M |
Контрольное задание № 9
Тема: «Электролиз»
Рассмотреть электролиз водного раствора соли по плану:
1. Запишите все возможные процессы на аноде, установите потенциалы процессов.
2. Сравните потенциалы анодных процессов и определите, какой из них протекает в первую очередь?
3. Выясните, меняется ли среда около анода, если да, то как и почему?
4. Запишите все возможные процессы на катоде, установите потенциалы процессов.
5. Сравните потенциалы катодных процессов и определите, какой из них протекает в первую очередь.
6. Установите, меняется ли среда около катода, если да, то как и почему?
7. Запишите итоговую схему процесса электролиза.
| № варианта | Состав и концентрация электролита | рН электролита и материал электродов |
| 0,1 M раствор Zn(NO3)2 | pH=4, катод – Zn, анод – С | |
| 0,5 M раствор MgBr2 | pH=6,5, электроды – Pt | |
| 0,1 M раствор NiSO4 | pH=5, электроды – Ni | |
| 0,1 M раствор FeJ2 | pH = 4,5, катод – Fe, анод – Pt | |
| 2 M раствор KNO2 | pH = 8, электроды – Pt | |
| 1 M раствор K2SO4 | pH = 7, катод – Fe, анод – Cu | |
| 0,01 M раствор Au(NO3)3 | pH = 6, катод – Au, анод – Pt | |
| 2 M раствор K4[Fe(CN)6] | pH = 7, электроды – Pt | |
| 0,5 M раствор CoCl2 | pH = 6,5, катод – Fe, анод – C | |
| 0,1 M раствор CuSO4 | pH = 5, катод – Al, анод – Сu | |
| 0,01 M раствор FeF3 | pH = 6, электроды – C | |
| 2 M раствор Cr(NO3)3 | pH = 5, катод – Ni, анод – Cr | |
| 0,5 M раствор K2SO4 | pH = 6,5, катод – Fe, анод – Sn | |
| 1 M раствор AgNO3 | pH = 7, катод – Cu, анод – Ag | |
| 0,001 M раствор HCl | pH = 3, катод – Sn, анод – Cu | |
| 0,01 M раствор MnCl2 | pH = 6, катод – Mn, анод – Pt | |
| 0,2 раствор SnCl2 | pH = 5, катод – Fe, анод – Sn | |
| 0,001 M раствор ZnCl2 | pH = 6,5, катод – C, анод – Zn | |
| 0,0 M раствор MgCl2 | pH = 7, катод – Mg, анод – Pt | |
| 0,01 M раствор K3PO4 | pH = 10, электроды – C | |
| 0,2 M раствор ZnSO4 | pH = 5, электроды – Zn | |
| 0,01 M раствор KBr | pH = 8, катод – C, анод – Ni |
Задачи для вариантов
3. Сколько кулонов электричества необходимо пропустить через раствор Bi(NO3)3, чтобы на катоде выделилось 0,2 г висмута? Запишите процессы на катоде, аноде и суммарный процесс электролиза.
6. При прохождении тока силой 1,5 А в течении 30 минут через раствор соли трехвалентного металла на катоде выделилось 1,07 г металла. Какой это металл?
9. Через раствор CuSO4 при рН=6 было пропущено 9650 кулонов электричества, при этом на катоде выделилось 2,86 г меди. Определите выход по току. Запишите суммарный процесс электролиза.
12. Чему равна толщина слоя цинкового покрытия, полученного в течении 1,5 часов при плотности тока 0,75 А/дм2 и выходе по току 90% (плотность цинка составляет 7*103 г/дм3)?
15. Определите, сколько граммов гидроксида натрия образовалось у катода при электролизе раствора хлорида натрия, если на катоде выделилось 2,8 л водорода, измеренного при нормальных условиях? Запишите суммарный процесс электролиза.
18. Рассмотрите схему электрохимической очистки серебра, имеющего примеси золота, меди, никеля. Куда помещают стержни с загрязненным серебром? На каком электроде получают чистое серебро? Что выступает электролитом? Запишите процессы на катоде и на аноде.
21. При электролизе раствора нитрата никеля на аноде выделилось 1120 мл кислорода, измеренного при нормальных условиях. Сколько граммов никеля выделилось на катоде, если выход по току равен 70%? Запишите суммарный процесс электролиза.
24. Через раствор хлорида олова SnCl2 пропущено 10 А×час электричества, при этом на катоде выделилось 18 граммов олова. Напишите уравнения реакций, протекающих на электродах. Рассчитайте выход олова по току.
Контрольное задание № 10
Тема: «Коррозия металлов»
Рассмотреть возможность коррозии сплава в заданной среде при доступе воздуха по плану:
1. Определить анод и катод в паре.
2. Записать процессы протекающие на анодных и катодных участках.
3. Рассчитать потенциалы катодных процессов.
4. Определить возможность коррозии.
| № вар. | Сплав | рН | № вар. | Сплав | рН |
| Fe-Ni | 10 | Cu-Al | 10 | ||
| Cd-Sn | 7 | Fe-Ni | 5 | ||
| Сo-Cu | 5 | Pb-Sn | 7 | ||
| Fe-Pb | 10 | Ag-Au | 10 | ||
| Cd-Ni | 7 | Fe-Mn | 5 | ||
| Cu-Pb | 5 | Al-Mg | 7 | ||
| Fe-Co | 10 | Cu-Ag | 10 | ||
| Co-Ni | 7 | Sn-Pb | 5 | ||
| Mg-Fe | 5 | Zn-Cd | 7 | ||
| Zn-Pb | 10 | Ag-Ni | 10 | ||
| Au-Ni | 7 | Fe-Bi | 12 | ||
| Mg-Ni | 5 | Bi-Sn | 4 | ||
| Ni-Sn | 10 | Bi-Pb | 2 | ||
| Co-Pb | 7 | Cd-Fe | 11 | ||
| Cd-Ag | 5 | Al-Mg | 9 |
Контрольное задание № 11
Тема: «Свойства металлов»
Написать реферат по следующему плану:
1. Электронная конфигурация атома. Возможные степени окисления.
2. Нахождение в природе и получение в свободном виде.
3. Физические и химические свойства.
4. Свойства соединений.
5. Сплавы. Применение металла и его соединений.
| № вар. | Металл | № вар. | Металл | № вар. | Металл |
| Бериллий | Олово | Молибден | |||
| Магний | Свинец | Вольфрам | |||
| Алюминий | Цинк | Цирконий | |||
| Титан | Медь | Платина | |||
| Ванадий | Серебро | Висмут | |||
| Хром | Кадмий | Сурьма | |||
| Марганец | Ниобий | Технеций, рений | |||
| Железо | Тантал | Индий, таллий | |||
| Кобальт | Ртуть | Осмий, иридий | |||
| Никель | Золото | Рутений, родий, палладий |
Вопросы для подготовки к экзамену
1. Основные законы химии: закон сохранения массы, постоянства состава, кратных отношений, закон Авогадро и следствие из него. Закон эквивалентов. Эквивалент простого и сложного вещества. Определение эквивалента по химическим реакциям.
2. Строение атома. Эволюция в развитии о строении атома (Томсон, Резерфорд, Бор). Современная теория строения атома. Корпускулярно-волновая двойственность электрона (Луи-де-Бройль, Девиссон, Джермер). Принцип неопределённости Гейзенберга. Уравнение Шредингера. Понятие о волновой функции и электронном облаке. Квантовые числа, их физический смысл. Энергетический уровень, подуровень, орбиталь, типы орбиталей. Принцип Паули и следствие из него. Принцип наименьшей энергии. Правило Гунда. Электронные формулы (конфигурации) атомов.
3. Периодический закон химических элементов и его физический смысл. Периодическая система элементов. Понятие о s-, p-, d-, f-элементах. Электронные аналоги: полные и неполные. Потенциал ионизации, сродство к электрону, электроотрицательность. Закономерности в изменениях этих величин в группах и периодах.
4. Химическая связь и её виды. Ковалентная связь, её образование по методу валентных связей. Обменный и донорно-акцепторный механизм образования ковалентной связи. Характеристики прочности ковалентной связи. Факторы, влияющие на неё. Понятие о σ- и π -связях. Свойства ковалентной связи: насыщаемость, направленность, поляризуемость. Полярность связи, полярность молекул. Теория гибридизации. Типы гибридизации связи. Строение молекул. Ионная связь, её свойства.
5. Энергетика химических процессов. Первый закон термодинамики. Внутренняя энергия и энтальпия. Закон Гесса, следствия из него. Термохимические уравнения и расчеты. Второй закон термодинамики. Энтропия, её изменение в химических процессах. Энергия Гиббса. Направленность химических процессов.
6. Понятие о механизме химической реакции. Гомогенные и гетерогенные системы. Условия протекания реакций. Понятия о скорости химической реакции. Средняя скорость и скорость истинная. Зависимость скорости химических реакций от концентрации (закон действующих масс) для гомогенных и гетерогенных реакций. Константа скорости реакции, её физический смысл, и размерность.Порядок и молекулярность реакции. Зависимость скорости реакции от температуры (правило Вант-Гоффа). Уравнение Аррениуса.
7. Обратимые химические реакции. Химическое равновесие. Константа равновесия для гомогенных и гетерогенных реакций, её физический смысл. Смещение химического равновесия (принцип Ле-Шателье). Связь энергии Гиббса и константы равновесия.
8. Понятие о дисперсных системах. Классификация дисперсных систем. Растворы, их виды. Способы выражения концентрации растворов. Растворимость. Свойства растворов неэлектролитов: давление пара растворителя, температуры кипения, замерзания, осмотическое давление (законы Рауля и Вант-Гоффа).
9. Растворы электролитов. Отклонение свойств электролитов от свойств растворов неэлектролитов. Изотонический коэффициент. Электролитическая диссоциация, её механизм. Сильные и слабые электролиты. Степень и константа диссоциации. Кажущаяся степень диссоциации. Реакции в растворах электролитов. Ионные уравнения реакций. Произведение растворимости. Условие выпадения осадка.
10. Диссоциация воды. Ионное произведение воды. Характеристика кислотности и щёлочности среды. Водородный показатель, его значения в различных средах. Индикаторы.
11. Гидролиз солей. Типичные случаи гидролиза (4 случая). Совместный гидролиз. Количественные характеристики гидролиза: степень гидролиза, константа гидролиза.
12. Валентность и степень окисления. Определение степени окисления атомов различных элементов. Процессы окисления и восстановления. Окислители и восстановители. Окислительно-восстановительные реакции. Их классификация и значение. Вывод коэффициентов в уравнениях окислительно-восстановительных реакций методом электронного баланса и электронно-ионным методом.
13. Химические источники тока. Их виды, преимущества и недостатки. Возникновение скачка потенциала на границе металл-электролит. Равновесный электродный потенциал, его зависимость от концентрации (уравнение Нернста). Устройство гальванических элементов. Процессы, происходящие на электродах элемента. Электрохимические схемы гальванических элементов. Определение стандартных электродных потенциалов. Типы гальванических элементов. Стандартный водородный электрод. Электрохимический ряд напряжений. Явление поляризации. Деполяризация. Топливные элементы. Аккумуляторы.
14. Электролиз. Его сущность. Анод и катод, процессы, происходящие на них. Напряжение разложения. Перенапряжение при электролизе. Последовательность разряда ионов на катоде и аноде. Электролиз с растворимым и нерастворимым анодом. Электролиз растворов и расплавов. Вторичные процессы при электролизе. Законы электролиза. Выход по току. Практическое применение электролиза.
15. Коррозия металлов. Масштабы и виды потерь от коррозии металлов. Способы оценки коррозионной стойкости металлов. Классификация коррозии по видам коррозионных разрушений, по видам коррозионных сред и механизму коррозионных процессов. Химическая коррозия, её сущность и виды. Оценка защитных свойств плёнок при химической коррозии. Методы защиты металлов от химической коррозии. Электрохимическая коррозия. Её виды и механизм протекания. Факторы, влияющие на скорость протекания электрохимической коррозии. Причины её возникновения. Перенапряжение и его роль при коррозии металлов. Методика расчёта возможности коррозии металлов и их сплавов в конкретных условиях.
16. Защита металлов от электрохимической коррозии. Изоляционные методы, электрохимические методы. Обработка коррозионно-агрессивных сред. Экономическое значение защиты металлов от коррозии.
17. Комплексные соединения, их классификация. Состав и структура. Химическая связь в комплексных соединениях. Диссоциация комплексных соединений. Константа нестойкости комплексного иона. Реакции образования комплексных соединений. Номенклатура. Практическое значение комплексных соединений.
18. Общие свойства металлов. Понятие: металл-элемент и металл-простое вещество. Классификация металлов. Распространение и формы нахождения металлических элементов в природе. Основные методы получения металлов. Получение чистых и сверхчистых металлов. Металлическая связь. Кристаллическая решётка металлов. Основные виды кристаллических решёток металлов. Физические свойства металлов. Химические свойства металлов. Интерметаллические соединения и твёрдые растворы. Виды твёрдых растворов. Восстановительная активность металлов и её количественная характеристика. Взаимодействие металлов с элементарными окислителями. Отношение металлов к воде, кислотам, щелочам.
Типовые задачи для подготовки к экзамену
1. Определить молярную массу эквивалента алюминия, если известно, что 54г его вытеснило 67,2л водорода, измеренного при нормальных условиях, из раствора соляной кислоты.
2. Составить электронную формулу атома Fe. Представить графическую схему заполнения электронами валентных орбиталей в нормальном и возбужденном состояниях. Определить возможные валентности.
3. Объяснить механизм образования молекулы NH3 по методу валентных связей. Представить электронно-точечную формулу молекулы и определить ее геометрическую форму.
4. Используя данные по теплотам образования и энтропии веществ определить, в каком направлении при стандартных условиях может самопроизвольно протекать реакция: Fe3O4 + CO = 3Feo + CO2 .
5. Вычислить, сколько энергии можно получить от сжигания 100л пропана.
6. Определить температуру, при которой становится возможным протекание реакции: Al2O3 + 3C = 2Al + 3CO .
7. При 150°С реакция заканчивается за 16мин. Принимая температурный коэффициент скорости реакции равным 2, рассчитать, через какое время эта реакция закончится, если ее проводить при 80°С.
8. Как изменится скорость реакции: Fe2O3 + 3CO = 2Feo + CO2
а) при увеличении концентрации CO в 2 раза;
б) при увеличении давления в 2 раза;
в) при увеличении температуры на 30°С ( 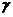 =2,5).
=2,5).
9. В каком направлении сместится равновесие в системе:
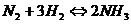
а) при повышении давления;
б) при уменьшении концентрации азота;
в) при повышении температуры (даны 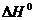 всех веществ).
всех веществ).
10. При состоянии равновесия в системе: N2(газ) + 3H2(газ) 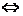 2NH3
2NH3
концентрации участвующих веществ равны: азота 3 моль/л; водорода 9моль/л; аммиака 4моль/л. Рассчитать константу равновесия и начальные концентрации азота и водорода, если начальная концентрация аммиака была равна 0.
11. На нейтрализацию 50мл раствора кислоты израсходовано 25мл 0,5 нормального раствора щелочи. Чему равна нормальность кислоты?
12. Смешали 300г 12%-ного раствора и 500г 30%-ного раствора KCl. Чему равна массовая доля KCl в полученном растворе?
13. При растворении 5г вещества в 200мл воды получился не проводящий тока раствор, кристаллизующийся при -1,45°С. Определить молекулярную массу растворенного вещества. (Криоскопическая постоянная воды равна 1,86).
14. Написать уравнения ступенчатой диссоциации следующих электролитов: H2CO3, Al(OH)3, KH2PO4, Al(OH)2Cl.
15. Вычислить рН 0,1М раствора гидроксида аммония NH4OH ( 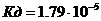 ).
).
16. Вычислить рН 0,1М раствора уксусной кислоты CH3COOH ( 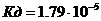 ).
).
17. Написать уравнения реакции гидролиза в молекулярной и ионной формах и определить характер среды для следующих солей: AlCl3, K3PO4, NaCN, Al2S3.
18. Определить рН 0,1М раствора Na2S, считая что гидролиз протекает по первой ступени. (Ступенчатые константы диссоциации сероводородной кислоты К1 и К2 равны соответственно 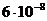 и
и 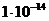 ).
).
19. Для реакции:Cr2(SO4)3 + K2SO4 + I2 + H2O = K2Cr2O7 + KI + H2SO4
вывести коэффициенты электронно-ионным методом, указать окислитель и восстановитель. По окислительно-восстановительным потенциалам реагирующих веществ определить, возможно ли самопроизвольное протекание реакции при стандартных условиях.
20. Для комплексного соединения K3[Fe(CN)6] указать комплексо-образователь, координационное число комплексообразователя и его степень окисления. Назвать это соединение и написать уравнение его диссоциации. Написать выражение константы нестойкости комплексного иона. Написать в молекулярной и ионной формах уравнения обменной реакции K3[Fe(CN)6] и FeCl2.
21. Гальванический элемент состоит из водородного электрода (рН=3) и цинкового электрода, погруженного в 0,1М раствор ZnSO4. Составить схему этого элемента. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Вычислить электродвижущую силу элемента. Указать, в каком направлении будут перемещаться электроны во внешней цепи при работе этого элемента.
22. Составить схемы двух гальванических элемнтов, в одном из которых медь служила бы катодом, а в другом - анодом. Написать уравнения реакций, протекающих при работе этих элементов, и вычислить значения стандартных ЭДС.
23. Написать уравнения процессов, происходящих при электролизе 0,1М раствора CuSO4 при рН=10 с
а) медными электродами;
б) угольными электродами.
24. При электролизе водного раствора NiSO4 на аноде протекает процесс: 2H2O – 4e‾→O2 + 4H+. Из какого материала сделан анод: а) из никеля; б) из меди; в) из золота?
25. Ток силой 6А пропускали через водный раствор серной кислоты в течение 1,5 часа. Вычислить массу разложившейся воды и объем выделившихся кислорода и водорода (условия нормальные).
26. В каком случае коррозия железа при повреждении покрытия будет происходить быстрее: хромированного или никелированного? Ответ обосновать.
27. Рассчитать возможность электрохимической коррозии пары Fe-Ni при рН=10 с доступом воздуха.
Список литературы
1. Ахметов Н. С. Общая и неорганическая химия. - М.: Высшая школа, 1998.
2. Введение в общую химию /Под ред. Г. П. Лучинского. - М.: Высшая школа, 1980.
3. Глинка Н. Л. Общая химия. /Под ред. В. А. Рабиновича. - Л.: Химия, 1988.
4. Глинка Н. Л. Задачи и упражнения по общей химии: Учеб. Пособие для вузов. /Под ред. В. А. Рабиновича и Х. М. Рубиной- Л.: Химия, 1986.
5. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. Т. 1-2. - М.: Мир, 1982.
6. Зайцев О. С. Общая химия. - М.: Высшая школа, 1990.
7. Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. - М.: Химия, 1981.
8. Кембел Дж. Современная общая химия. Т. 1-3. - М.: Мир, 1975.
9. Коровин Н. В. Общая химия. Учебник для вузов. - М.: Высшая школа, 1998.
10. Крестов Г. А. Теоретические основы неорганической химии. - М.: Высшая школа, 1982.
11. Крестов Г. А., Березин Б. Д. Основные понятия современной химии. - Л.: Химия, 1983.
12. Лидин Р. А., Аликберова Л. Ю., Логинова Г. П. Неорганическая химия в вопросах. - М.: Химия, 1991.
13. Лучинский Г. П. Курс химии. - М.: Высшая школа, 1985.
14. Общая химия. /Под ред. Е. М. Соколовской. - М.: Изд-во МГУ, 1990.
15. Ремдсен Э. Н. Начала современной химии. - Л.: Химия, 1989.
16. Романцева Л. М., Лещинская З. Л., Суханова В. А. Сборник задач и упражнений по химии. - М.: Высшая школа, 1991.
17. Рипан Р., Четяну И. Неорганическая химия. Т. 1-2. - М.: Мир, 1972.
18. Угай Я. А. Общая и неорганическая химия. - М.: Высшая школа, 1997.
19. Фролов В. В. Химия. - М.: Высшая школа, 1986.
20. Харин А. Н., Катаева Н. А., Харина Л. Т. Курс химии. - М.: Высшая школа, 1983.
21. Хомченко Г. П., Цитович И. К. Неорганическая химия. - М.: Высшая школа, 1987.
22. Хьюи Дж. Неорганическая химия. – М.: Химия, 1987.
Приложения
Таблица 1
