Элементов Д.И. Менделеева
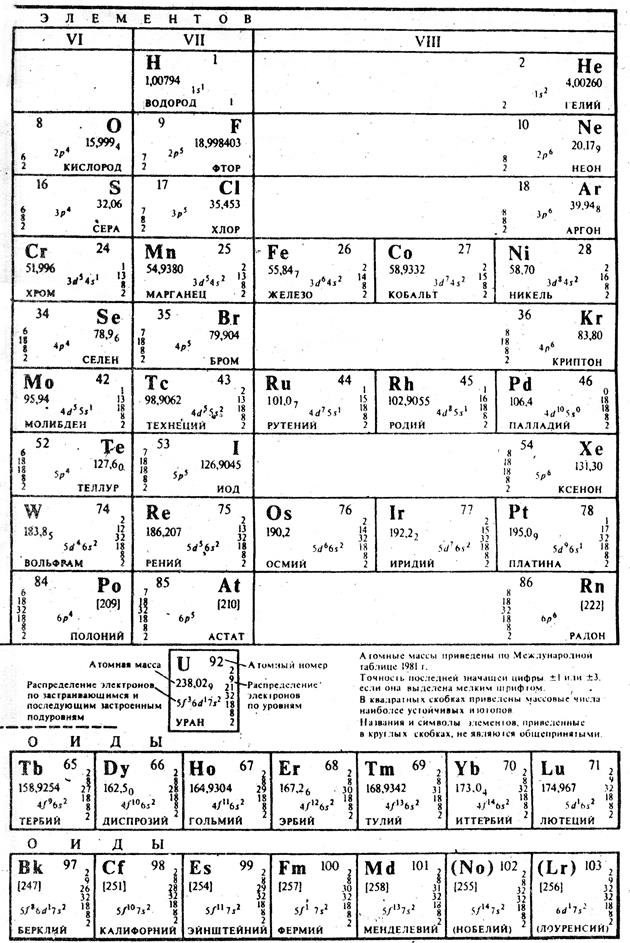
Периодическая система
Таблица 11. (вариант

Элементов Д.И. Менделеева
Длинной формы)
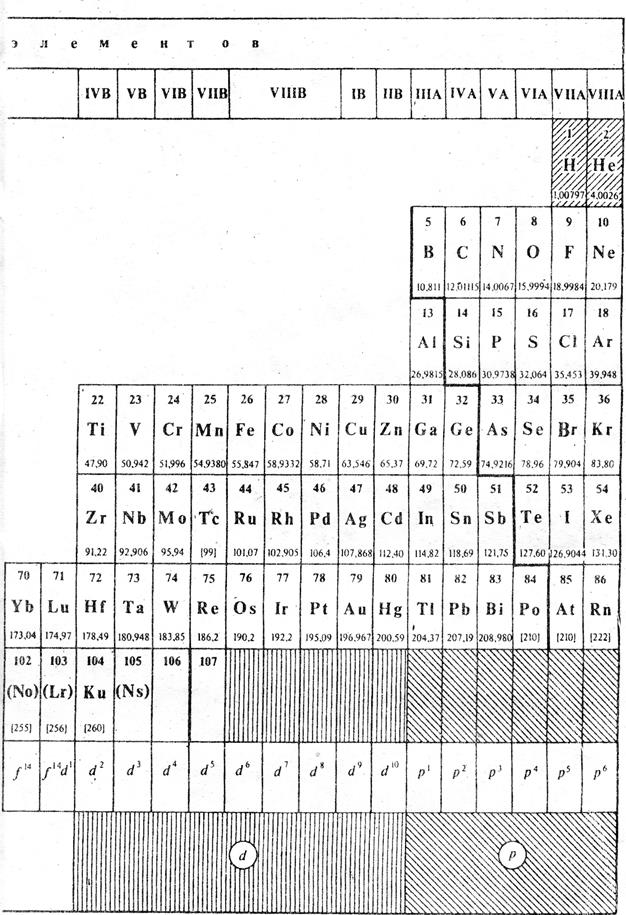
 Таблица 12.
Таблица 12.
Растворимость солей и оснований в воде (Р – растворимое, М – малорастворимое,
Н – практически нерастворимое вещество, прочерк означает, что вещество
не существует или разлагается водой)
| Анионы | Катионы | ||||||||||||||||||
| Li+ | Na+, K+ | NH+4 | Cu2+ | Ag+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ | Zn2+ | Hg2+ | Al3+ | Sn2+ | Pb2+ | Bi3+ | Cr3+ | Mn2+ | Fe3+ | Fe2+ | |
| Cl– | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | – | Р | Р | Р | Р |
| Br– | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | М | Р | Р | М | – | Р | Р | Р | Р |
| I– | Р | Р | Р | – | Н | Р | Р | Р | Р | Р | Н | Р | Р | Н | – | Р | Р | – | Р |
| NO–3 | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | Р | Р | – | Р | Р |
| CH3COO– | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | – | – | Р | – | Р |
| S2– | Р | Р | Р | Н | Н | – | Р | Р | Р | Н | Н | – | Н | Н | Н | – | Н | Н | Н |
| SO2–3 | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | – | – | Н | Н | – | Н | – | Н |
| SO2–4 | Р | Р | Р | Р | М | Р | М | Н | Н | Р | – | Р | Р | Н | – | Р | Р | Р | Р |
| CO2–3 | Р | Р | Р | – | Н | Н | Н | Н | Н | Н | – | – | – | Н | Н | – | Н | – | Н |
| SiO2–3 | Р | Р | – | – | – | Н | Н | Н | Н | Н | – | Н | – | Н | – | – | Н | Н | Н |
| Cr2–4 | Р | Р | Р | Н | Н | Р | М | М | Н | Н | Н | – | – | Н | Н | Р | Н | – | – |
| PO3–4 | Н | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| OH– | Р | Р | Р | Н | – | Н | М | М | Р | Н | – | Н | Н | Н | Н | Н | Н | Н | Н |
Таблица 13.
Основные классы неорганических веществ
| Вещества | Классификация веществ | П р и м е р ы | |
| Простые | Металлы (85 элементов) | s-элементы p-элементы Al, Ga, In, Ti, Ge, Sn, Bi. d-элементы f-элементы | |
| Неметаллы (22 элемента) | s-элементы (Н, Не) p-элементы B, C, Si, N, P, O, S, Se, Te галогены благородные газы | ||
| Сложные | Бинарные соединения | гидриды карбиды нитриды оксиды сульфиды галиды | LiH, NaH, CaH2, BaH2 Be2C, CaC2, Al4C3 Na3N, Mg3N2, Si3N4 Na2O, CaO, Al2O3 K2S, ZnS, Fe2S3 NaCl, BaCl2, FeCl3 |
| Соли | Средние кислые (гидро-) основные (гидроксо-) | NaNO3, Al2(SO4)3, K3PO4 NaHSO4, KH2PO4, Ca(H2PO4)2 MgOHCl, (CuOH)2SO4, Fe(OH)2Cl | |
| Гидроксиды | кислоты амфолиты (амфотерные) основания | HNO3, H2SO4, H3PO4 Zn(OH)2, Al(OH)3, Be(OH)2 H2ZNO2, H3AlO3, H2BeO2 KOH, Ba(OH)2, Ni(OH)3 |
Взаимосвязь простых веществ, оксидов, оснований и кислот
(реакции солеобразования)
1. Металл + кислота ® соль + водород
Fe + 2HCl = FeCl2 + H2
2. Металл + неметалл ® соль бескислородной кислоты
2Fe + 3Cl2 = 2FeCl3
3. Металл (1) + соль (1) ® соль (2) + металл (2)
Fe + CuCl2 = FeCl2 + Cu
4. Основной оксид + кислотный оксид ® соль
BaO + SO3 = BaSO4
5. Основной оксид + кислота ® соль + вода
BaO + 2HCl = BaCl2 + H2O
6. Основание + кислота ® соль + вода (реакция нейтрализации)
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
7. Основание + кислотный оксид ® соль + вода
Ba(OH)2 + SO3 = BaSO4 + H2O
8. Основание (1) + соль (1) ® соль (2) + основание (2)
Ba(OH)2 + K2SO4 = BaSO4 + 2KOH
9. Соль (1) + кислота (1) ® соль (2) + кислота (2)
BaCl2 + H2SO4 = BaSO4 + 2HCl
10. Соль (1) + соль (2) ® соль (3) + соль (4)
BaCl2 + K2SO4 = BaSO4 + 2KCl
Оглавление
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ.. 3
ПРОГРАММА.. 5
ЛИТЕРАТУРА.. 12
КОНТРОЛЬНЫЕ ЗАДАНИЯ.. 12
КОНТРОЛЬНОЕ ЗАДАНИЕ 1. 12
КОНТРОЛЬНОЕ ЗАДАНИЕ 2. 50
Таблица вариантов контрольных заданий.. 74
Приложение.. 79
Химия
Методические указания, программа, решение типовых задач
и контрольные задания для студентов заочного отделения
инженерно-технических специальностей
| Подп. к печати | Формат 60´84 1/16 | |
| Усл. печ. л. 5,04 | Уч.-изд. л. 5,5 | Тираж экз. |
| Изд. № 001 | Заказ № |
РИО СПбГАСЭ, лицензия ЛР № 040849
Член Издательско-полиграфической Ассоциации университетов России
СПб государственная академия сервиса и экономики
192171, г. Санкт-Петербург, ул. Седова, 55/1
Отпечатано в ИИГ НОУ «АКТиБ», 192171, СПб., ул. Седова, 55/1
Лицензия ИД №05598 от 14.08.2001 г.
