Периодическая система элементов Д. И. Менделеева
Теоретическое введение
В 1869 г. Д. И. Менделеев сообщил об открытии периодического закона, современная формулировка которого такова: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов. Наглядным выражением закона служит периодическая система Д. И. Менделеева.
Периодическая система состоит из периодов и групп. Периодом называется последовательный ряд элементов, расположенных в порядке возрастания заряда ядра их атомов, электронная конфигурация которых изменяется от ns1 до ns2np6 (или до ns2 у первого периода). Все периоды начинаются с s-элемента и заканчиваются p-элементом (у первого периода s-элементом). Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным. Число элементов в периодах 2–8–18–32 соответствует максимально возможному числу электронов на соответствующих энергетических уровнях: на первом – 2, на втором – 8, на третьем – 18, на четвертом – 32 электрона. В периодах слева направо ослабевают металлические и усиливаются неметаллические свойства и кислотный характер соединений.
По вертикали в таблице расположено 8 групп, в которых один под другим размещены элементы, имеющие сходные свойства. Атомы элементов одной и той же группы имеют одинаковое число валентных электронов. Количество валентных электронов в оболочке атома, как правило, равно номеру группы, в которой находится элемент, и определяет высшую степень окисления элемента. Группы делятся на подгруппы – главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги). В главных (А) подгруппах расположены s-элементы (I, II группы) и p-элементы (III-VIII группы). В атомах элементов главных подгрупп валентные электроны находятся на s- и р-подуровнях внешнего энергетического уровня и общее их число равно номеру группы. В главных подгруппах при переходе сверху вниз усиливаются металлические свойства, основной характер соединений и их устойчивость в низшей степени окисления. Например, для элементов IV А-группы возможные степени окисления +2 и +4. Для углерода наиболее характерна степень окисления +4, поэтому четырехвалентные соединения углерода устойчивы и не проявляют окислительных свойств. У свинца металлические свойства выражены сильнее, чем у углерода и для него характерна степень окисления +2, вследствие чего соединения свинца со степенью окисления +4 являются окислителями.
В побочных (В) подгруппах располагаются d- и f-элементы. Валентные электроны в атомах d-элементов находятся на s-подуровне внешнего и d-подуровне предвнешнего энергетических уровней. В побочных подгруппах, кроме подгруппы скандия, при переходе сверху вниз усиливаются неметаллические свойства элементов, кислотный характер соединений и их устойчивость в высшей степени окисления.
d-элементы побочных подгрупп склонны проявлять переменную степень окисления. Характер образуемых ими соединений зависит от степени окисления элемента. Соединения, в которых элемент находится в низшей степени окисления, имеют основной характер, в высшей степени окисления – кислотный, в промежуточной – амфотерный. Например, хром проявляет степени окисления +2, +3, +6 и характер образуемых им оксидов следующий:
Cr+2O 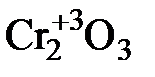 Cr+6O3
Cr+6O3
основной амфотерный кислотный
Элементы главных и побочных подгрупп сильно отличаются по своим свойствам. Общими для элементов главных и побочных подгрупп являются формулы высших оксидов и их гидроксидов. У высших оксидов и соответствующих им гидроксидов элементов I–III групп (кроме бора) преобладают основные свойства, IV–VII групп – кислотные.
| Группа | I | II | III | IV | V | VI | VII | |
| Формула высшего оксида | 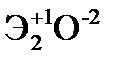 | 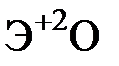 | 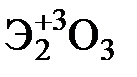 | 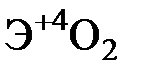 | 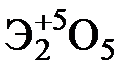 | 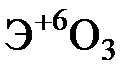 | 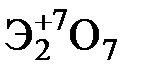 | |
| Формула гидроксида | ЭОН | Э(ОН)2 | Э(ОН)3 | Н2ЭО3 | НЭО3 | Н2ЭО4 | НЭО4 | |
| Основания | Кислоты | |||||||
Для элементов главных подгрупп общими являются формулы водородных соединений (гидриды):
| Подгруппа | I A | II A | III A | IV A | V A | VI A | VII A |
| Формула гидрида | 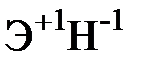 | 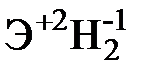 | 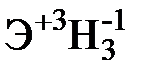 | 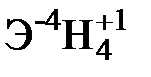 | 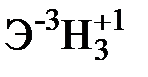 | 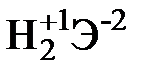 | 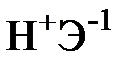 |
| Твердые | Газообразные |
Так как электронное строение атомов элементов изменяется периодически, то, соответственно, периодически изменяются и свойства элементов, определяемые их электронным строением, например, энергия ионизации и сродство к электрону.
Энергия, необходимая для отрыва электрона от атома, называется энергией ионизации (Еи). В результате ионизации атом превращается в положительно заряженный ион Э0–е→Э+. Еи выражается в электрон-вольтах (эВ) и является мерой восстановительной способности элемента. Чем меньше Еи, тем сильнее выражена восстановительная способность элемента. У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается. Поэтому энергия ионизации постепенно увеличивается, а восстановительные свойства ослабевают. В главных подгруппах с увеличением порядкового номера элемента радиус атома увеличивается, а энергия ионизации уменьшается. Восстановительная активность s- и p-элементов увеличивается. В побочных подгруппах при увеличении порядкового номера Еи увеличивается, восстановительная активность d-элементов понижается.
Энергия, выделяющаяся при присоединении электрона к атому с превращением его в отрицательный ион, называетсясродством к электрону(Ее). Э+е→Э–. Ее выражается в электрон-вольтах и является мерой окислительной способности элемента. Чем больше Ее, тем сильнее выражены окислительные свойства элемента. С увеличением порядкового номера элемента Ее по периодам возрастает, по группам уменьшается. Наибольшее сродство к электрону имеют фтор, кислород, хлор. Они же являются и самими сильными окислителями.
Примеры решения задач
Пример 4.1. Какую высшую и низшую степени окисления проявляют фосфор, сера, хлор? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение. Данные элементы находятся соответственно в VA, VIA, VIIA-группах и имеют электронную конфигурацию внешнего энергетического уровня 3s23p3; 3s23p4; 3s23p5.
Таблица 4.1
Степени окисления фосфора, серы, хлора
| Элемент | Степень окисления | Соединения | |
| Высшая | Низшая | ||
| P S Cl | +5 +6 +7 | –3 –2 –1 | H3PO4; PH3 SO3; Na2S HClO4; HCl |
Для большинства элементов главных подгрупп высшая степень окисления равна номеру группы, в которой находится элемент, а низшая степень окисления равна разности N–8, (N – номер группы). Ответ на вопрос задачи см. в табл. 3.1.
Пример 4.2. На каком основании марганец и бром расположены в одном периоде (4), одной VII группе, но в разных подгруппах – А и В?
Решение. Электронная конфигурация атомов марганца и брома соответственно – 25Mn [Ar]3d54s2; 35Br [Ar]4s24p5. Количество заполняющихся энергетических уровней в атомах указанных элементов равно 4, значит, это элементы 4 периода. Сумма валентных электронов у каждого атома равна 7, следовательно, это элементы VII группы. Но валентные электроны атома марганца расположены на 4s-подуровне внешнего и d-подуровне предвнешнего уровня, значит, это d-элемент и расположен в побочной подгруппе (В). Валентные электроны атома брома находятся на p- и s-подуровнях внешнего уровня. Следовательно, это p-элемент и расположен в главной подгруппе (А).
Пример 4.3. У какого из элементов четвертого периода – ванадия или мышьяка – сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом?
Решение. Электронные конфигурации атомов данных элементов 23V [Ar]3d34s2; 33As [Ar]4s24p3. Ванадий – d-элемент VB-группы, а мышьяк – p-элемент VA-группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Принадлежность элемента к металлам или неметаллам определяется, в основном, числом электронов на внешнем энергетическом уровне. Атомы металлов на внешнем уровне содержат 1–2, реже 3 электрона. Металлы проявляют только восстановительные свойства и, отдавая свои электроны, переходят в положительно заряженные ионы. Отрицательно заряженных ионов металлы не образуют. Атомы неметаллов на внешнем энергетическом уровне имеют 4–7 электронов. Они могут как принимать электроны (т. е. выступать в качестве окислителей), так и отдавать электроны (т. е. быть восстановителями) У неметаллов окислительная функция выражена сильнее, чем восстановительная. Атомы неметаллов образуют отрицательно заряженные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия выражены сильнее, чем у мышьяка. Газообразное соединение с водородом образует неметалл мышьяк (As–3H3).
Пример 4.4. Вычислите молярную массу и назовите элемент, высший оксид которого отвечает формуле ЭО3, образует с водородом газообразное соединение, массовая доля водорода в котором 1,54%.
Решение. Вычислим содержание элемента в гидриде, приняв массу гидрида за 100%: 100 – 1,54 = 98,46%, т. е. на 98,46 частей массы элемента приходится 1,54 частей массы водорода или на 98,46 г элемента приходится 1,54 г водорода. Зная, что молярная масса эквивалентов водорода равна 1 г/моль, определим молярную массу эквивалентов элемента в гидриде по закону эквивалентов:
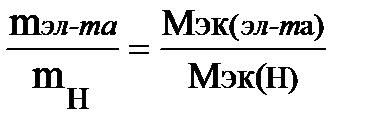 ;
; 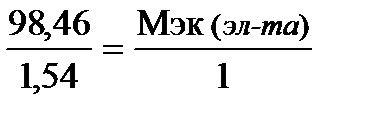 ; Мэк (эл-та) = 63,9 г/моль.
; Мэк (эл-та) = 63,9 г/моль.
Элемент образует высший оксид ЭО3, следовательно, он находится в VI группе. Его высшая степень окисления в соединении с кислородом +6, а низшая – в соединении с водородом –2. Находим молярную массу элемента из соотношения 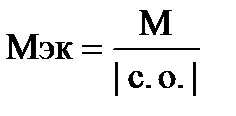 . М = 63,9×2 = 127,8 г/моль. Следовательно, искомая молярная масса элемента 127,8, а элемент – теллур.
. М = 63,9×2 = 127,8 г/моль. Следовательно, искомая молярная масса элемента 127,8, а элемент – теллур.
