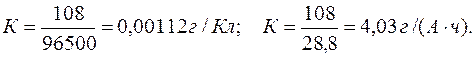Примеры решения типовых задач. Пример 1.Ряд активности металлов, электродных потенциалов
Пример 1.Ряд активности металлов, электродных потенциалов.
Задача 1. Медная пластинка массой 10 г была погружена в раствор нитрата серебра, затем промыта водой и высушена. Масса ее оказалась равной 11,0 г. Сколько серебра из раствора выделилось на пластинке?
Решение. Для решения этой задачи необходимо знать стандартные электродные потенциалы металлов, т.е. место их в ряду напряжений (ряду активности металлов Бекетова).
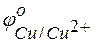 = +0.34 В;
= +0.34 В; 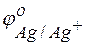 = +0.80 В.
= +0.80 В.
Из этих положительных потенциалов стандартный электродный потенциал меди менее положителен, следовательно, пойдёт реакция вытеснения:
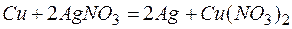
Для того чтобы вычислить количество серебра, выделившегося на медной пластинке, надо помнить, что медная пластинка в этой реакции и сама растворяется, теряя в массе.
Обозначим количество растворившейся меди через x г, тогда масса медной пластинки с учётом её растворения будет (10-х) г, масса выделившегося серебра на основе реакции:
64,0 г Cu – 2 ∙ 108 г Ag
х г Cu – (1+х) г Ag
216х =64+64х, 152x=64, x=0,42 г.
Таким образом, в течение реакции растворилось 0,42 г меди и выделилось 1,0 + 0,42 = 1,42 г серебра.
Пример 2.Работа гальванического элемента и расчёт ЭДС.
Задача 1. Напишите уравнения реакций, происходящих при работе гальванического элемента, состоящего из цинковой и серебряной пластин, опущенных в растворы своих солей с концентрацией катионов, равной 1 моль/л.
Решение. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
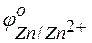 = –0,76 В;
= –0,76 В; 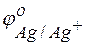 = +0,80 В.
= +0,80 В.
Металл, имеющий более отрицательное значение электродного потенциала при работе гальваничеcкого элемента, является анодом. В данном случае протекают реакции:
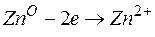
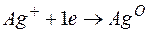
т.е. цинк, являясь анодом, растворяется при работе гальваничеcкого элемента, а серебро осаждается в виде металла на катоде. ЭДС гальванического элемента равна
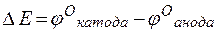 =
= 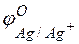 –
– 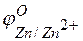 = +0,8 – (–0,76) =1,56 В.
= +0,8 – (–0,76) =1,56 В.
Пример 3. Зависимость электродных процессов от концентрации.
Задача 1. Рассчитайте, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода равна 0,1 моль/л, а у катода – 0,001 моль/л.
Решение. Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
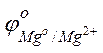 = –2,38 В;
= –2,38 В; 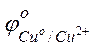 = +0.34 В.
= +0.34 В.
Следовательно, анодом будет магниевый электрод, катодом – медный. Электродный потенциал металла, опущенного в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
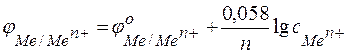 ,
,
где: с – концентрация катиона, моль/л;
п – число электронов, принимающих участие в реакции.
Отсюда потенциал магниевого электрода
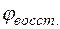 = –2,38 +
= –2,38 + 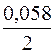 lg10–1 = –2,38 + 0,029(–1) = –2,409 В.
lg10–1 = –2,38 + 0,029(–1) = –2,409 В.
Потенциал медного электрода
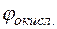 = +0,34 +
= +0,34 + 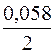 lg10–3 = +0,34 + 0,029(–3) = +0,253 В.
lg10–3 = +0,34 + 0,029(–3) = +0,253 В.
Тогда для гальванического элемента
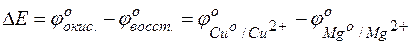 = +0,253–(–,409)=2,662В.
= +0,253–(–,409)=2,662В.
Пример 4. Определение возможности протекания реакции в гальвани-ческом элементе.
Задача 1. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса ΔGо298, укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Fe0 + Cd2+= Fe2+ + Cd0.
Решение. Надо составить схему гальванического элемента, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Fe 0 – 2е = Fe 2+
Cd 2+ + 2е = Cd 0.
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальваничекого элемента:
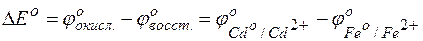 = –0,40– (–0,44)=0,04 В.
= –0,40– (–0,44)=0,04 В.
Изменение величины энергии Гиббса с величиной ЭДС связано соотношением:
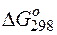 = – nF
= – nF 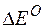 ,
,
где: 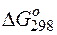 – изменение величины энергии Гиббса;
– изменение величины энергии Гиббса;
n – число электронов, принимающих участие в реакции;
F–число Фарадея;
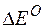 – ЭДС гальванического элемента.
– ЭДС гальванического элемента.
Находим 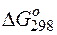 = –2∙96500∙0,04= – 7720 Дж.
= –2∙96500∙0,04= – 7720 Дж.
Так как 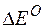 >0,
>0, 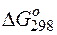 <0, следовательно, данную реакцию можно осуществить в гальваническом элементе. Реакция в прямом направлении идёт самопроизвольно.
<0, следовательно, данную реакцию можно осуществить в гальваническом элементе. Реакция в прямом направлении идёт самопроизвольно.
Пример 5. Расчет количества вещества, выделившегося при электролизе.
Задача 1. Какая масса меди осаждается на катоде при прохождении тока силой 2 А через раствор медного купороса в течение 15 минут?
Решение. Сначала нужно узнать количество электричества, прошедшее через раствор, выразив его в кулонах (1Кл=А.с). Количество электричества Q=I 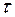 =2.15.60=1800 Кл. Молярная масса эквивалента меди (II) равна 64,0/2=32 г/моль. Следовательно:
=2.15.60=1800 Кл. Молярная масса эквивалента меди (II) равна 64,0/2=32 г/моль. Следовательно:
| 96500 Кл – 32 г |
| 1800 Кл – х г |
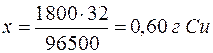 |
Пример 6. Определение электрохимического эквивалента и выхода по току.
Задача 1. При электролизе водного раствора AgNO3 в течение 50 минут при силе тока 3А выделилось 9,6 г серебра. Электролиз проводился с растворимым анодом. Напишите уравнение реакций катодного и анодного процессов и определите электрохимический эквивалент серебра в г/Кл и г/А.ч и выход по току.
Решение. Нитрат серебра диссоциирует:
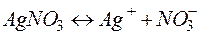
Процессы, протекающие на электродах:
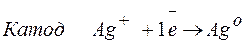
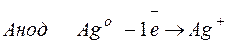
Молярная масса эквивалента AgО =108 г/моль.
Определяем массу серебра, которая выделилась бы теоретически при прохождении через раствор данного количества электричества:
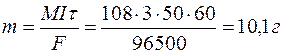
Выход по току
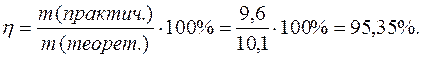
Электрохимический эквивалент