Понятие о скорости химической реакции
Среднюю скорость реакции 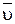 определяют как изменение концентраций (ΔС) одного из участников реакции во времени (∆τ):
определяют как изменение концентраций (ΔС) одного из участников реакции во времени (∆τ):
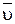 = ± ∆С / ∆τ; г/л∙с или моль/л∙с.
= ± ∆С / ∆τ; г/л∙с или моль/л∙с.
Скорость химической реакции зависит от концентрации веществ, температуры и наличия катализатора. Химические реакции могут быть гомогенными и гетерогенными. В гомогенных реакциях и исходные, и полученные вещества находятся в одной и той же фазе; при этом исходные вещества взаимодействуют по всему объёму. Фазой называется однородная часть системы, ограниченная от других частей системы поверхностью раздела. В гетерогенных реакциях и исходные вещества, и продукты реакции находятся в разных фазах, а взаимодействие реагентовпроисходит по поверхности раздела фаз.
3.2. Зависимость скорости реакции от концентрации реагирующих
веществ. Закон действующих масс
Гомогенные элементарные химические реакции подчиняются закону действующих масс. При постоянных температуре и объёме скорость реакции пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам. Для элементарной, гомогенной реакции
a A + b B ® e E + d D.
Скорость выражается кинетическим уравнением 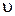 = k СаА ∙ СbB. Здесь СА и СB – молярные концентрации реагирующих веществ (моль/л); a и b – стехиометрические коэффициенты; k – константа скорости.
= k СаА ∙ СbB. Здесь СА и СB – молярные концентрации реагирующих веществ (моль/л); a и b – стехиометрические коэффициенты; k – константа скорости.
Величина константы скорости k зависит от природы реагирующих веществ, температуры и не зависит от концентрации реагирующих веществ. Константа скорости численно равна скорости реакции при концентрацииреагирующих веществ,равных единице.
В кинетическом уравнении газовых реакций вместо концентраций можно использовать парциальные давления 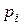 (давление, которое создают молекулыданного компонента газовой смеси).
(давление, которое создают молекулыданного компонента газовой смеси).
Пример 1. Как изменится скорость реакции 2NO (г) + С12 (г) = 2NOCl (г), если при постоянной температуре:
а) повысить концентрацию NO в 2 раза;
б) повысить давление в системе в 2 раза?
Решение.
1. Влияние концентрации на скорость реакции. Кинетическое уравнение дляданной реакции имеет вид: 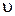 = k ·
= k · 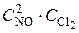 . При повышении концентрации NО в 2 раза она станет 2CNO и кинетическое уравнение принимает вид
. При повышении концентрации NО в 2 раза она станет 2CNO и кинетическое уравнение принимает вид
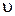 1 = k ·
1 = k · 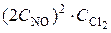 , отсюда
, отсюда 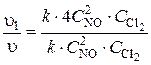 = 4.
= 4.
Следовательно, скорость химической реакции возросла в 4 раза.
2. Влияние давления на скорость реакции. Исходные вещества газообразны, поэтому,используя их парциальные давления, получаем следующее кинетическое уравнение: 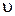 = k
= k 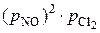 . При повышении давления в системе в 2 раза парциальное давление каждого компонента возрастает в 2 раза и становится равным 2 рNO и 2
. При повышении давления в системе в 2 раза парциальное давление каждого компонента возрастает в 2 раза и становится равным 2 рNO и 2 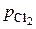 . Следовательно,
. Следовательно, 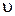 2 = k ·
2 = k · 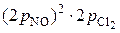 = 8 k ·
= 8 k · 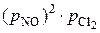 .
.
Отсюда 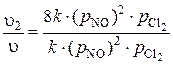 = 8.
= 8.
Химические реакции по механизму протекания условно делят на простые исложные. Простые реакции, протекающие в одну стадию, называют элементарными. Реакции, протекающие в несколько стадий, называют сложными. Кроме того, реакции подразделяют по признаку молекулярности и порядку реакции. Общий порядок реакции определяют как сумму показателей степеней при концентрациях в кинетическом уравнении. Число молекул, принимающих участие в химической реакции, определяет молекулярность реакции.
Пример 2. Реакция 2 NO2 (г) + F2 (г) = 2 NO2F (г) протекает по стадиям:
1) NO2 (г) + NO2 (г) = N2O4 (г) (быстрая);
2) N2O4 (г) + F2 (г) = 2NO2F (г) (медленная).
Какой стадией лимитируется процесс? Напишите кинетическое уравнение скорости реакции. Определите молекулярность, общий порядок реакции и порядок реакции по веществу F2.
Решение. Наиболее медленной стадией является реакция 2. Именно она определяет общую скорость всего процесса. Поэтому кинетическое уравнение можно записать в виде 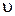 = k2 ·
= k2 · 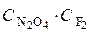 . Согласно этому уравнению сумма показателей степеней при концентрациях реагирующих веществ равна двум. Следовательно, сложная трехмолекулярная реакция 2NO2 (г) + F2 (г) = 2NO2F (г) является реакцией второго порядка. Порядок реакции по веществу F2 (г) равен 1, так как показатель степени при концентрации этого вещества (
. Согласно этому уравнению сумма показателей степеней при концентрациях реагирующих веществ равна двум. Следовательно, сложная трехмолекулярная реакция 2NO2 (г) + F2 (г) = 2NO2F (г) является реакцией второго порядка. Порядок реакции по веществу F2 (г) равен 1, так как показатель степени при концентрации этого вещества ( 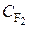 ) в кинетическом уравненииравен 1.
) в кинетическом уравненииравен 1.
Пример 3. Напишите кинетическое уравнение для гетерогенной реакции горения серы:S (к) + O2 (г) = SО2 (г).
Решение. Рассматриваемая реакция гетерогенная и протекает на поверхности раздела фаз. Поэтому скорость реакциипри постоянной температуре будет зависеть не только от концентрации кислорода, но и от поверхности раздела фаз. Концентрация твердой фазы (сера) до полного ее исчезновения остается постоянной. В процессе взаимодействия изменяется только количество ее. Поэтому, скорость реакции рассчитывается на единицу поверхности твердой фазы и в кинетическое уравнение реакции входит только концентрация кислорода
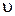 = k ·
= k · 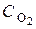 .
.
