Примеры решения типовых задач. Пример 1. Олово спаяно с серебром
Пример 1. Олово спаяно с серебром. Укажите, какой из металлов будет окисляться при коррозии, если сплав находится в чистой влажной атмосфере (Н2О +О2)? Приведите схему образующегося гальванического элемента и вычислите его ЭДС для стандартных условий.
Решение. Находим значения стандартных электродных потенциалов:
EоO2+2H2O/4OH-=+0,4 B; EоSn2+/Sn =−0,14 B; EоAg+/Ag =+0,8 B.
Олово является более активным металлом и в образующейся гальванической паре будет анодом.
Олово окисляется, а на катоде восстанавливается кислород. Следовательно, на электродах данного гальванического элемента происходят следующие процессы:
(−) А: Sn 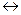 Sn2++ 2
Sn2++ 2  ;
;
(+) К (Sn, Cu): O2 + 2H2O + 4 
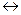 4OH-;
4OH-;
Схема образующегося гальванического элемента:
 4
4 
(−) 2Sn/2Sn2+½H2O, O2½4OH-/2H2O+O2 (Ag) (+),
ЭДС=Eо2H2O+O2/4OH-−EоSn2+/Sn =0,4−(−0,14)=+0,54 B.
Пример 2. Приведите уравнения анодного и катодного процессов, происходящих при коррозии стали в кислой среде и влажной атмосфере (Н2О+О2).
Решение. Сталь содержит карбид железа (Fe3C), являющийся основной примесью. Карбид железа менее активен, чем железо, поэтому анодом является железо, катодом – карбид железа.
В кислой среде на аноде происходит процесс окисления железа, на катоде – восстановление ионов водорода:
(−) А (Fe): Feо 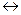 Fe2++ 2
Fe2++ 2  ,
,
(+) К (Fe3C): 2H+ + 2 
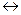 H2
H2  .
.
При атмосферной коррозии стали протекают следующие процессы:
(−) А (Fe): Feо 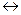 Fe2+ + 2
Fe2+ + 2  ,
,
(+) К (Fe3C): O2 + 2H2O + 4 
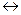 4OH-.
4OH-.
Пример 3. Предложите протектор для защиты изделия из алюминиевой бронзы от коррозии во влажной атмосфере. Приведите уравнения протекающих процессов.
Решение. Алюминиевая бронза – это сплав меди с алюминием.
Протектор, согласно принципу его действия, должен иметь наиболее отрицательное значение электродного потенциала, чем потенциал меди (EоCu2+/Cu=+0,34 B) и алюминия (EоAl3+/Al=−1,662 B), например магний (EоMg2+/Mg =−2,36 B). В образующемся гальваническом элементе Mg будет играть роль анода и разрушаться:
(−) А: Mg 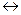 Mg2++ 2
Mg2++ 2  .
.
На катоде (изделии) будет протекать процесс разрядки кислорода:
(+) К: O2 + 2H2O + 4 
 4OH-.
4OH-.
Продуктом коррозии является Mg(OH)2.
МИНЕРАЛЬНЫЕ ВЯЖУЩИЕ ВЕЩЕСТВА
Природные силикаты
Из минералов в природе наиболее распространены соединения кремния, поскольку большая часть земной коры состоит из силикатов и кремнезема. Силикаты не имеют характерного цвета, многие из них прозрачны или просвечивают, они тверды и тугоплавки, со стеклянным блеском и по внешнему виду напоминают камни. Помимо кремния и кислорода, они содержат алюминий, магний, железо, кальций и калий, а также гидроксильные группы или воду. В некоторых силикатах присутствует фтор, бериллий, бор, титан.
Силикаты состоят из катионов и анионов. В центре правильного тетраэдра находится атом кремния, в вершинах – атом кислорода. Анионы SiO4-4 могут соединяться в более сложные системы путем образования кислородного мостика между атомами кремния, как это представлено на схеме:
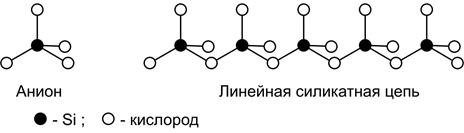
Такие цепочки, достигающие значительных размеров, должны рассматриваться как гигантские анионы.
Важную группу силикатов составляют алюмосиликаты (силикаты, содержащие алюминий), относящиеся к группе полевых шпатов.
В кристаллической решетке кремний может замещаться алюминием, при этом образуются различные минералы:
ортоклаз – К2О·Аl2О3·6 SiO2,
альбит – Nа2О·Аl2О3·6 SiO2,
анортит – СаО·Аl2 О3·6 SiO2.
