Механизм действия ферментов. Общее представление о катализе и биокатализе
Общее представление о катализе и биокатализе
Вероятность протекания химической реакции определяется разницей между свободной энергией исходных веществ и продуктов реакции. Если она больше у исходных веществ, то возможно самопроизвольное течение реакции. Скорость ее зависит от энергетического барьера, который необходимо преодолеть реагирующим веществам, причем высота его неодинакова для разных реакций. Энергетический барьер - это разница между средней энергией реагирующих молекул и минимальной энергией, необходимой для протекания химической реакции.
Кинетическая энергия реакционно-способных молекул достаточна для преодоления энергетического барьера, однако в обычных условиях лишь небольшая доля молекул обладает такой энергией. Для преодоления этого барьера молекулам вещества нужно сообщить какое-то количество энергии. Дополнительное количество энергии, которое нужно сообщить молекулам 1 моль вещества для перевода их в реакционно-способное состояние при данной температуре, называется энергией активации. Во всякой химической реакции существует переходное состояние, которое характеризуется высокой свободной энергией и определяется как состояние взаимодействующих молекул, соответствующее вершине энергетического барьера. Чем выше энергия активации, тем выше высота энергетического барьера и тем ниже скорость реакции. Скорость реакции пропорциональна концентрации молекул в переходном состоянии. Связывание реагирующих веществ с катализатором приводит к появлению нового переходного состояния, характеризующегося меньшей энергией активации по сравнению с переходным состоянием не катализируемой реакции (рис.7.1).
Ферменты и небиологические катализаторы, подчиняясь общим законам катализа, имеют следующие общие признаки:
- они катализируют только энергетически возможные реакции;
- не изменяют направления реакции;
- ускоряют наступление равновесия обратимой реакции и не сдвигают его;
- не расходуются в процессе реакции.
Однако ферменты обладают особыми качествами, отличающими их от небиологических катализаторов. Эти отличия связаны с особенностями строения ферментов, как веществ белковой природы:
- скорость ферментативного катализа намного выше, чем небиологического, так как ферменты сильнее снижают энергию активации. Так, например, энергия активации реакции разложения пероксида водорода без катализатора составляет 75,6 кДж/моль, с участием катализатора платины - 49,14 кДж/моль, а с участием фермента каталазы - 23,1 кДж/моль;
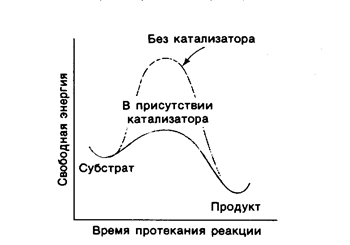 |
Рис. 7.1. Энергетический барьер не катализируемой и катализируемой реакций
- ферменты обладают высокой специфичностью действия;
- ферменты катализируют реакции в «мягких» условиях, т.е. при обычном давлении, температуре тела и рН, близкому к нейтральной среде, в то время как небиологические катализаторы действуют при высоком давлении, температуре и крайних значениях рН;
- активность ферментов регулируется, что позволяет изменять скорость превращения веществ в организме, т.е. приспосабливаться к действию различных факторов;
- скорость ферментативной реакции прямопропорциональна количеству фермента, тогда как для небиологического катализатора не существует строгой зависимости скорости реакции от количества катализатора, поэтому недостаток фермента означает низкую скорость превращения вещества в организме и наоборот, одним из путей приспособления клеток организма является образование дополнительных количеств фермента.
Стадии ферментативного катализа.
Большую роль в развитии представлений о механизме действия ферментов сыграли классические работы Л. Михаэлиса и М.Ментен, развивших положение о фермент-субстратных комплексах.
Процесс ферментативного катализа можно описать следующей схемой:
I II III
E + S ¾¾¾® ES ¾¾¾® EZ ¾¾¾® EP ¾¾¾® E + P
На 1-й стадии, обычно непродолжительной по времени, происходит связывание субстрата с активным центром фермента с образованием фермент-субстратного комплекса ES. На этой стадии изменение энергии активации незначительно (рис.7.2)
Вторая стадии лимитирует скорость всего катализа. Она наиболее медленная и длительность её зависит от энергии активации данной химической реакции .На этой стадии происходит расшатывание связей субстрата , их разрыв и образование новых связей . Благодаря образованию активированных переходных комплексов EZ снижается энергия активации субстрата.
3-я стадия, как и 1-я, непродолжительна по времени, на ней
осуществляется отделение продукта реакции от активного центра фермента.
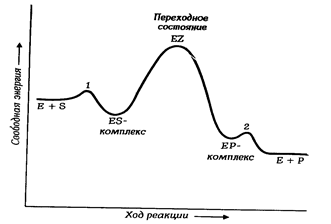 |
Рис. 7.2. Энергетическая схема ферментативной реакции. В точках 1 и 2 имеются малые энергетические барьеры.
Кинетика ферментативных реакций.
Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (фермента и субстрата), условий их взаимодействия (концентрации веществ, рН среды, температуры, влияния активаторов и ингибиторов) на скорость ферментативной реакции.
Общие принципы кинетики химических реакций применимы и к ферментативным реакциям, однако при изучении кинетики последних следует учитывать одну важную особенность этих реакций - явление насыщение фермента субстратом.
При низкой концентрации субстрата скорость реакции пропорциональна концентрации субстрата - это реакция 1-го порядка (рис. 7.3. участок а).
 |
Рис. 7.3. Зависимость скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
Реакция смешанного порядка (участок б) характеризуется постепенным снижением роста скорости реакции при дальнейшем увеличении концентрации субстрата. Наконец, при определенной концентрации субстрата, скорость реакции достигает максимума и не зависит от концентрации субстрата (участок в графика) - реакция нулевого порядка. В этом случае происходит полное насыщение активного центра фермента субстратом и скорость реакции зависит только от концентрации фермента.
Математическое выражение зависимости скорости реакции от концентрации субстрата описывается уравнением Михаэлиса-Ментен:
V= 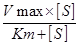 ; где Vmax - максимальная скорость реакции;
; где Vmax - максимальная скорость реакции;
Km - константа Михаэлиса
Константа Михаэлиса показывает концентрацию субстрата при которой скорость реакции равна половине максимальной. Чем выше константа Михаэлиса, тем ниже сродство фермента к субстрату и наоборот.
Так, гексокиназа имеет более высокое сродство к глюкозе, чем глюкокиназа и работает при невысоких концентрациях глюкозы. Фермент глюкокиназа работает при больших концентрациях глюкозы, имея невысокое сродство к глюкозе.
