Механизм действия ферментов. Специфичность действия ферментов(стереохимическая, реакционная и субстратная:абсолютная,групповая). Структура и роль каталитического центра.
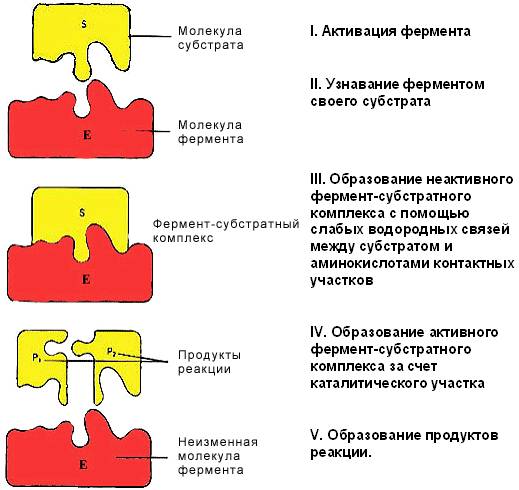
На первом этапе (I) происходит активация фермента путем связывания с аллостерическим центром регуляторных веществ (например, гормонов), что приводит к изменению конформации активного центра фермента и увеличению его способности связывать молекулу субстрата.
На втором этапе (II)происходит 'узнавание' ферментом своего субстрата (см. Специфичность действия фермента).
На третьем этапе (III) происходит формирование неактивного фермент-субстратного комплекса за счет образования гидрофобных и водородных связей между радикалами аминокислотных остатков субстратного центра (контактные площадки) и соответствующими группировками в молекуле субстрата. Молекула субстрата удерживается вблизи активного центра, но химическим преобразованиям еще не подвергается.
На четвертом этапе (IV) образуется активный фермент-субстратный комплекс. При этом происходит химическое преобразование субстрата с участием каталитического центра и кофермента (если речь идет о сложном ферменте). В результате этого молекула субстрата меняет сою пространственную конфигурацию, в ней происходит перераспределение энергии и уменьшается прочность связей.
На пятом этапе (V) фермент-субстратный комплекс становиться нестабильным и затем преобразуется в комплекс фермент-продукт, который распадается на продукты реакции и фермент. Фермент из реакции выходит в неизменном виде.
Специфичность по отношению к субстрату – это предпочтительность фермента к субстрату определенной структуры в сравнении с другими субстратами. Различают 4 вида субстратной специфичности ферментов:
1. Абсолютная специфичность – способность фермента катализировать превращение только одного субстрата. Например – глюкокиназа фосфорилирует только глюкозу, аргиназа расщепляет только аргинин, уреаза – мочевину.
2. Относительная специфичность – фермент катализирует превращение нескольких субстратов, имеющих один тип связи. Например – липаза расщепляет сложноэфирную связь в триацилглицеролах.
3. Относительная групповая специфичность – фермент катализирует превращение нескольких субстратов, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав субстратов. Например, все протеолитические ферменты расщепляют пептидную связь, но пепсин – образованную аминогруппами ароматических аминокислот, химотрипсин – образованную карбоксильными группами этих же аминокислот, трипсин – пептидную связь, образованную карбоксильной группой лизина, аргинина.
4. Стереохимическая специфичность – фермент катализирует превращение только одного стереоизомера. Например, бактериальная аспартатдекарбоксилаза катализирует декарбоксилирование только L-аспартата и не действует на D-аспарагиновую кислоту.
Реакционная специфичность фермента -это специфичность фермента к определённой реакции.
Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Например, каталитический центр "серин-гистидиновых" ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K.
Каталитический центр простого фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, расположенных на разных участках полипептидной цепи. Образование каталитического центра происходит одновременно с формированием третичной структуры белковой молекулы фермента. Чаще всего в состав каталитического центра простого фермента входят остатки серина, цистеина, тирозина, гистидина, аргинина, аспарагиновой и глутаминовой кислот.
Классификация ферментов
