Установление нормальности раствора NaOH по соляной кислоте
П р и б о р ы и м а т е р и а л ы.Раствор соляной кислоты, полученный на этапе 2, пипетки, конические колбы на 100-200 мл, индикатор фенолфталеин, дистиллированная вода, бюретки.
Т е о р е т и ч е с к а я ч а с т ь.Реакция идет по уравнению:
NaOH + HCI = NaCI + H2O.
За точкой эквивалентности среда становится щелочной и индикатор меняет окраску.
Х о д р а б о т ы.В две колбочки пипеткой наливают по 25 мл раствора соляной кислоты, полученного на этапе 2, добавляют 2 капли фенолфталеина и титруют из пипетки щелочью, данной преподавателем, до перехода окраски
в чуть розовый цвет. Нормальность гидроксида натрия равна, моль-экв/л:
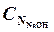 =
= 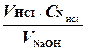 ,
,
где VHCI- объем соляной кислоты, мл,
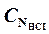 - нормальность раствора соляной кислоты, моль-экв/л,
- нормальность раствора соляной кислоты, моль-экв/л,
VNaOH- объем гидроксида, пошедшего на титрование, мл.
Э т а п 6
Определение содержания NH3 в испытуемом растворе методом
Обратного титрования
П р и б о р ы и м а т е р и а л ы. Растворы аммиака с неизвестной концентрацией, метилрот или метилоранж, 0,1 н раствор соляной кислоты, полученный на этапе 2, раствор гидроксида, стандартизированного на этапе 5, пипетки на 10 и 25 мл, колбы на 50 мл.
Т е о р е т и ч е с к а я ч а с т ь.Из-за летучести аммиака в процессе титрования возможны его потери, поэтому аммиак определяют обратным титрованием.
К испытываемому раствору аммиака добавляют заведомый избыток титрованного раствора соляной кислоты, полученного на этапе 2, а затем избыток кислоты оттитровывают раствором едкого натра, стандартизованного на этапе 5. Происходят следующие реакции:
NH4OH + HCI = NH4CI + H2O,
HCIизб + NaOH = NaCI + H2O.
В точке эквивалентности в растворе содержатся NH4CI и NаCI, следовательно, значение рН будет определяться с помощью процесса гидролиза хлорида аммония по уравнению:
NH4CI + HOH Û NH4OH + HCI.
Величина рН рассчитывается по формуле:
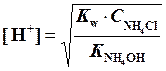 ,
,
или
рН = 7 - 1/2 × рК NH4CI – ½ × lgСNH4CI.
Вычисленная величина рН = 7 - 4,75/2 – ½ × lg0,1 = 5,13, поэтому лучше использовать индикатор метилрот (рТ = 5), если же использовать метилоранж (рТ = 4), титрование ведут до желто-оранжевой окраски из желтой.
Х о д р а б о т ы.После получения двух колбочек с испытуемым раствором в каждую из них вводят пипеткой по 25 (или 10) мл раствора НСI, полученного на этапе 2, добавляют 2-3 капли метилрота или метилоранжа и титруют гидроксидом натрия, стандартизованного на этапе 5 соответственно до оранжево-красной или оранжево-желтой окраски, в зависимости от индикатора. Содержание аммиака, г:
m = 10-3 × (VHCI × 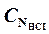 – VNaOH ×
– VNaOH × 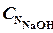 ) × f × MNH3,
) × f × MNH3,
где VHCI- объем соляной кислоты, мл,
MNH3- молекулярная масса аммиака, г/моль,
f- фактор эквивалентности аммиака,
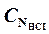 - нормальность раствора соляной кислоты, моль-экв/л,
- нормальность раствора соляной кислоты, моль-экв/л,
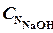 - нормальность раствора гидроксида натрия, моль-экв/л.
- нормальность раствора гидроксида натрия, моль-экв/л.
О т ч е т
Опишите ход лабораторной и оформите результаты в виде табл. 8, ответьте на контрольные вопросы.
Т а б л и ц а 8. Опытные данные опыта лабораторной метода нейтрализации
| Масса навески, тетрабората натрия (карбоната натрия), г | Требуемый объем тетрабората натрия (карбоната натрия), мл | Нормальность (средняя) раствора соляной кислоты, ,моль-экв/л | Содержание (среднее) соды в растворе соды, г | Нормальность (средняя) раствора гидроксида натрия, моль-экв/л | Содержание аммиака, (среднее), г |
Контрольные вопросы
1. На чем основано применение карбоната натрия как установочного вещества (по аналогии с бурой)?
2. Опишите особенности нейтрализации карбоната натрия кислотой.
3. В каких случаях в методе нейтрализации лучше использовать метилоранж, в каких – метилрот, почему?
4. Расскажите о сущности метода нейтрализации. Приведите примеры прямого и обратного титрования.
Лабораторная работа № 6.
Окислительно-восстановительное титрование.
Перманганатометрия.
Определение содержания железа (II) в растворе соли Мора
Ц е л ь р а б о т ы. Установить точную концентрацию вторичного стандарта – перманганата калия – по щавелевой кислоте и определить
с помощью редокс-титрования содержание железа в растворе.
Т е о р е т и ч е с к а я ч а с т ь. Взаимодействие между щавелевой кислотой и перманганатом калия протекает через ряд промежуточных стадий
с постепенным изменением валентности марганца и выражается следующим уравнением:
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2 + 8H2O.
На скорость этой реакции оказывают каталитическое воздействие ионы Mn2+. Первые капли раствораKMnO4обесцвечиваются с трудом, так как перманганат-ионы с оксалат-ионами взаимодействуют медленно, но стоит появиться небольшому количеству ионов Mn2+,как дальнейшее обесцвечивание перманганата происходит практически мгновенно. Это происходит из-за образования промежуточных соединений, которые быстро реагируют с ионами MnO4-,особенно при нагревании. Такой тип реакций, на скорость которых оказывают каталитическое воздействие их продукты, называют автокаталитическими. Предполагают, что каталитическое воздействие Mn2+объясняется следующими промежуточными стадиями процесса:
3MnSO4 + 2KMnO4 + 2 H2O = 5MnO2 + K2SO4 + H2SO4,
2MnO2 + 3H2SO4 + H2C2O4 = Mn2(SO4)3 + 2CO2 + 4 H2O,
Mn2(SO4)3 + H2C2O4 = 3 MnSO4 + 2CO2 + H2SO4.
Нагревание раствора щавелевой кислоты до 70-80 0С ускоряет реакцию между перманганатом и щавелевой кислотой, так как при этом промежуточные стадии реакции протекают с достаточной скоростью. Но допускать кипячения нельзя, так как щавелевая кислота в этом случае разлагается:
H2C2O4 = H2О + CO2 + CO.
Реакция между ионами Fe2+ и MnO4- в растворе соли МораFeSO4(NH4)2SO4 протекает по уравнению:
2 KMnO4 + 10FeSO4 + 8H2SO4 = 2 MnSO4 + 5Fe2(SO4)3 + K2SO4 + 2H2O.
Константа равновесия данной реакции имеет большую величину, реакция проходит практически до конца:
К = 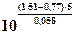 .
.
П р и б о р ы и м а т е р и а л ы. Колбы на 100-150 мл, бюретки, пипетки на 10-25 мл, плитки, стеклянные стаканы, асбестовые сетки, 0,1 н раствор щавелевой кислоты, раствор серной кислоты 1:4, дистиллированная вода, раствор перманганата, контрольный раствор соли Мора.
Х о д р а б о т ы. В три колбы вносят пипеткой по 10 или 25 мл раствора щавелевой кислоты, приливают 10-20 мл раствора серной кислоты, разбавляют на глаз примерно равным объемом дистиллированной воды. Содержимое колбы нагревают (не кипятят!) и титруют раствором перманганата калия при непрерывном помешивании. При титровании приливают сначала из бюретки несколько капель раствора перманганата и ожидают, пока раствор обесцветится. Обесцвечивание следующей порции раствора идет быстрее. Конец титрования определяют по появлению бледно-розовой окраски, не исчезающей при помешивании содержимого колбы в течение 20 с. Титрование повторяют три раза и берут среднее из трех определений.
Нормальность раствора перманганата равна:
CN = 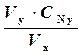 ,
,
где Vx, Vy, - соответственно объем пошедшего на титрование перманганата и налитой в колбу кислоты,CNy - нормальность щавелевой кислоты.
После определения нормальности перманганата его раствором титруют контрольный раствор соли Мора с добавлением 10 мл серной кислоты до появления бледно-розовой окраски, устойчивой в течение 20 с. Титрование повторяют трижды и берут среднее значение концентрации. Содержание железа в растворе соли Мора, г:
mх = V1 ×CN1 ×Эх/1000,
где V1, CN1, Эх - соответственно объем пошедшего на титрование перманганата, его нормальная концентрация и эквивалентная молекулярная масса железа.
О т ч е т
Опишите кратко ход лабораторной работы и оформите результаты
в виде табл. 9.
Таблица 9. Опытные данные лабораторной работы
по перманганатометрии
| Номер колбы | Объем пошедшего на титрование перманганата, мл | Концентрация перманганата, моль-экв/л | Среднее значение концентрации, моль-экв/л | Содержание железа в растворе соли Мора, г | Среднее значение массы железа в растворе соли Мора, г |
| V1 | C1 | Cср | m1 | mср | |
| V2 | C2 | m2 | |||
| V3 | C3 | m3 |
Контрольные вопросы
1. Опишите свойства и примеры установочных веществ, объясните, относится ли к ним щавелевая кислота и почему.
2. Почему нельзя кипятить щавелевую кислоту, но нагревать необходимо при титровании?
3. По каким веществам, кроме щавелевой кислоты, можно стандартизировать перманганат калия?
4. Почему перманганат необходимо стандартизировать?
