Специфичность действия ферментов
Ферменты обладают высокой специфичностью действия. Специфичность действия фермента предопределяется строгим соответствием пространственной конфигурации субстрата и активного центра фермента.
Формирование активного центра фермента начинается уже на ранних этапах синтеза белка – на рибосоме, когда линейная одномерная структура пептидной цепи превращается в трехмерное тело строго определенной конфигурации.
Основной движущей силой в возникновении трехмерной структуры является взаимодействие радикалов аминокислот в водной среде приопределенных значениях ионной силы, рН раствора и температуры и т.д. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, в то время как полярные радикалы оказываются ориентированными в сторону воды. В какой–то момент возникает термодинамически наиболее выгодная стабильная биологически активная конформация молекулы белка.
При уникальном сочетании нескольких аминокислотных остатков, расположенных в разных точках полипептидной цепи формируется каталитический центр фермента. Чаще всего в каталитических центрах однокомпонентных ферментов встречаются остатки сер, гис, три, арг, цис, асп, глу и тир, содержащие в радикале группы –ОН, –СООН,–NН2, –НS.
Так как каталитический центр однокомпонентного фермента возникает в тот момент, когда молекула приобретает присущую ей третичную структуру, то третичной структуры фермента под влиянием тех или иных факторов может привести к деформации каталитического центра и изменению ферментативной активности. У двухкомпонентных ферментов в состав каталитического центра еще входят группа небелковой природы. Добавочную группу, прочно связанную с белком называют простетической группой; легко отделяемую от белка и способную к самостоятельному существованию – коферментом.
В активном центре условно различают каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом и связывающий центр, обеспечивающий специфическое сродство к субстрату и формировании его комплекса с ферментом. В свою очередь молекула субстрата также содержит функционально различные участки: одну специфическую связь (или группу атомов), подвергающуюся атаке со стороны фермента, и один или несколько участков, избирательно связываемых ферментом.
Пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выражено формулой «перчатка–рука». При этом в субстрате уже деформируются некоторые валентные связи и он, таким образом, подготавливается к дальнейшему каталитическому видоизменению, а в молекуле фермента происходят конформационные перестройки. В настоящее время гипотеза Кошланда постепенно дополняется гипотезой топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи.
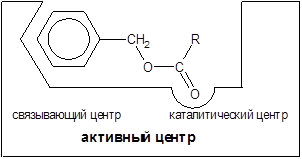
Рисунок 1 – Схема активного центра фермента
Различают групповую и абсолютную специфичность. При групповой специфичности фермент катализирует реакции одного типа более чем с одним структуроподобным субстратом. Например, триацилглицероллипаза расщепляет жиры (сложноэфирную связь), включающие разные жирно-кислотные остатки. Другой пример, – действие ферментов, гидролизующих пептиды и белки: они расщепляют пептидные связи, образованные разными аминокислотами. При абсолютной специфичности фермент каталитически ускоряет одну единственную реакцию. Примером таких ферментов могут служить аргиназа, гидролитически расщепляющая аргинин на орнитин и мочевину, уреаза, катализирующая распад мочевины на СО2 и NH3.
Существует еще и стереоспецифичность, когда фермент катализирует превращение определенного оптического изомера – L- или D- или геометрического – цис- или транс-.
Например, фумараза катализирует превращение только фумаровой кислоты (транс-изомер), но не действует на малеиновую кислоту (цис-изомер).
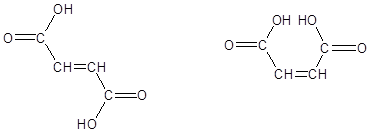
фумаровая кислота малеиновая кислота
Свойство специфичности можно установить на примере действия ферментов a– амилазы – (1,4–a–глюкан–4–глюканогидролаза) и сахаразы (a–D – глюкопиранозил– (1®2) –b–D – фруктофуранозид).
a–Амилаза катализирует гидролиз 1,4–гликозидных связей в молекуле крахмала и гликогена без какого–либо определенного порядка с образованием небольшого количества олигосахаридов, декстринов и мальтозы. В зависи-мости от состава и свойств декстрины делятся на:
¾ амилодекстрины, окрашивающиеся раствором йода в фиолетово-синий цвет;
¾ эритродекстрины, окрашивающиеся йодом в красно–бурый цвет;
¾ ахродекстрины, окрашиваются в желтый цвет;
¾ мальтодекстрины, не окрашивающиеся йодом;
Сахараза расщепляет сахарозу на a–D–глюкозу и b–D фруктозу.
Принцип метода.Действие a–амилазы на крахмал обнаруживают по реакции с йодом: нерасщепленный крахмал с йодом дает синее окрашивание, а расщепленный окрашивается в цвет в зависимости от глубины гидролиза: от сине–фиолетового до желтого.
Действие сахаразы на сахарозу можно установить по реакции Троммера. Сахароза не содержит свободный полуацетальный гидроксил альдегидной группы, поэтому не дает реакции Троммера. Реакция Троммера может быть положительной, только в том случае, если сахароза расщепляется на свои составные части a–D– глюкозу и b–D–фруктозу под действием фермента сахаразы.
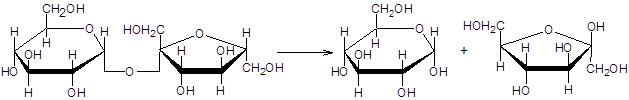
2-(a-D-глюкопиранозил)-b-D-фруктофуранозид a-D-глюкоза b-d-фруктоза
(сахароза)
Реакция Троммера заключается на способности свободной альдегидной или кетонной группы молекулы сахара (глюкозы и фруктозы) взаимодействовать со щелочным раствором окисной меди (II) и восстанавливать ее до оксида меди (I), выпадающего в виде осадка красного цвета.
СuSO4 + 2 NаОН ¾¾® Сu (OH)2 + Nа2SO4
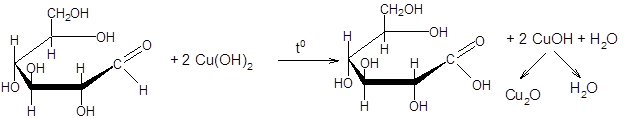
Ход работы. Приготовление растворов ферментов.
5 г хлебопекарных дрожжей растирают в ступке с битым стеклом, прибавляют понемногу 10 мл дистиллированной воды и оставляют стоять на 30 мин. при 37 °С при периодическом помешивании, затем фильтруют. Фильтрат является источником сахаразы.
Берут 4 пробирки, нумеруют. В первые две наливают по 1 мл 0,1 % –го раствора крахмала, в две другие – по 2 мл 1 %-го раствора сахарозы. В первую и четвертую добавляют по 1 мл раствора амилазы (слюна, разведенная в 10 раз), во вторую и третью – 1 мл сахаразы. Содержимое пробирок хорошо перемешивают и выдерживают в термостате при 37–40 °С 10 минут. Затем пробирки охлаждают водопроводной водой. В пробирки с крахмалом вносят несколько капель раствора Люголя; в пробирках с сахарозой проводят реакцию Троммера, для чего добавляют равный объем 10 % раствора едкого натра. Затем по каплям добавляют 5 % раствор сернокислой меди до появления неисчезающей мути гидроокиси меди. Осторожно нагревают содержимое пробирок. Появление красного осадка (оксида меди (I)) указывает на положительную реакцию Троммера.
