Общие свойства аминокислот
Кислотно-основные свойства.Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов (цвиттерионов), а не в виде недиссоциированных молекул (последнюю структуру приводят для удобства представления, однако все аминокислоты при физиологических значениях рН имеют структуру цвиттериона).
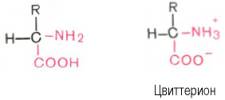
При растворении в воде кристаллическая аминокислота, например аланин, может реагировать или как кислота (донатор протона):
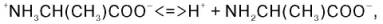
или как основание (акцептор протона):
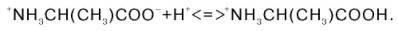
Если радикалы аминокислот нейтральные, то они почти не оказывают влияния на диссоциацию α-карбоксильной группы или α-аминогруппы, и величины рК (отрицательный логарифм константы диссоциации) остаются относительно постоянными. Вследствие этого кривые диссоциации почти всех нейтральных аминокислот накладываются друг на друга и могут быть рассмотрены на примере аланина. Если к раствору аланина (например, 0,1 М) в воде постепенно прибавлять сильную кислоту (0,1 М раствор НСl) или сильную щелочь (0,1 М раствор NaOH), то получим кривую титрования аланина, типичную для всех нейтральных аминокислот (рис. 1.6).
Кажущиеся величины рК' для α-карбоксильной группы и α-аминогрупп (т.е. значения рН, при которых эти группы в среднем наполовину диссоциированы) довольно сильно различаются, составляя pK1 = 2,34 и рК2 = 9,69. При низком значении рН (ниже pK1') почти все молекулы аланина являются полностью протонированными и несут положительный заряд. Другими словами, при высокой концентрации водородных ионов в растворе тенденция к диссоциации водорода из структуры аланина оказывается незначительной. Из кривой титрования видно, что точка перехода между ветвями кривой располагается при рН 6,02. Это означает, что при данном значении рН суммарный (или средний) электрический заряд молекулы аланина равен нулю и она не перемещается в электрическом поле ни к аноду, ни к катоду (изоэлектрическое состояние). Такое значение рН получило название изоэлектрической точки и обозначается pI. Изоэлектрическая точка аминокислот, не содержащих дополнительных NH2- или СООН-групп, представляет собой среднее арифметическое между двумя значениями рК':
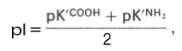
соответственно для аланина
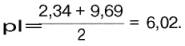
Изоэлектрическая точка ряда других аминокислот, содержащих дополнительные кислотные или основные группы (аспарагиновая и глутаминовая кислоты, лизин, аргинин, тирозин и др.), зависит, кроме того, от кислотности или основности радикалов этих аминокислот. Для лизина, например, рI должна вычисляться из полусуммы значений рК' для α- и ε-NН2-групп. Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов с протонированной аминогруппой и диссоциированной карбоксильной группой. Следует отметить, что при физиологических значениях рН тканей и крови (7,1 и 7,4 соответственно) аминокислоты (за ислючением гистидина) не обладают измеримой буферной емкостью. Эту способность они приобретают только при значениях рН, близких к величинам их рК (т.е. при рН 1,7-3,2 и 8,6-10,8).
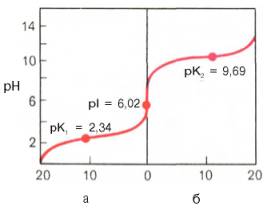
Рис. 1.6.Кривые, полученные при титровании 0,1 М раствора аланина 0,1 М раствором НСl (а) и 0,1 М раствором NaOH (б).
Стереохимия аминокислот.Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Будучи растворенными в воде (или в НСl), они способны вращать плоскость поляризованного луча (исключение составляет глицин). Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода (т. е. атома углерода, все четыре валентные связи которого заняты различными заместителями). Величины удельного вращения вправо или влево являются количественной характеристикой оптической активности, и для большинства аминокислот [а]2р составляет от 10 до 30°. Примерно половина аминокислот белков оказалась правовращающей, их обозначают знаком «+» (Ала, Иле, Глу, Лиз и др.), а чуть меньше половины - левовращающей (Фен, Трп, Лей и др.), их обозначают знаком «–». Все эти аминокислоты принадлежат к L-ряду, а величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора, в котором измеряют оптическое вращение.
Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Ниже представлены L- и D-стереоизомеры глицеринового альдегида. Рядом показаны пространственные конфигурации L-и D-аланина:
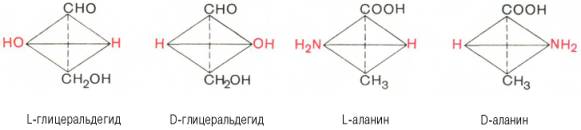
Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида. Следует еще раз подчеркнуть, что символы L и D означают принадлежность данной аминокислоты по своей стереохимической конфигурации к L- или D-ряду, в то время как знак «+» или «–» указывает на направление изменения плоскости поляризации светового луча. Среди белковых аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два асимметрических атома углерода. Следовательно, если не в природе, то, во всяком случае, в лаборатории возможно получить четыре стереоизомерные формы этих аминокислот . Для треонина известны все четыре изомера. Если условно обозначить символом L выделенный из природных белков треонин, то его зеркальное отображение называют D-треонином. Два других изомера, получивших наименование диастереоизомеров, или аллоформ, также могут иметь L- и D-формы. Структурные конфигурации всех четырех стереоизомеров треонина можно представить следующими формулами:
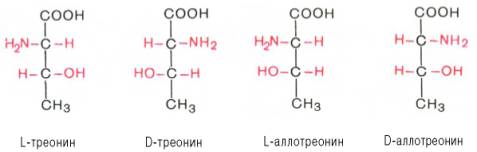
Как отмечалось, в белковой молекуле D-аминокислоты не обнаружены , однако в живой природе они широко распространены.
Так, D-изомеры глутаминовой кислоты, аланина, валина, фенилаланина, лейцина и ряда других открыты в клеточной стенке бактерий; в составе некоторых антибиотиков, в частности актиномицинов, бацитрацина, грамицидинов А и S, содержатся аминокислоты D-конфигурации.
Аминокислотный состав (качественный и количественный) многих тысяч белков, полученных из разных источников, выяснен (табл. 1.4).
При анализе данных табл. 1.4 виден ряд закономерностей. На долю дикарбоновых аминокислот и их амидов в большинстве белков приходится до 25–27% всех аминокислот. Эти же аминокислоты вместе с лейцином и лизином составляют около 50% всех аминокислот. В то же время на долю таких аминокислот, как цистеин, метионин, триптофан, гистидин, приходится не более 1,5–3,5%. В протаминах и гистонах отмечено высокое содержание основных аминокислот аргинина и лизина, соответственно 26,4 и 85,2% (см. «Химия простых белков»).
Химические реакции для открытия и определения аминокислот в гидролизатах белков.В курсе органической химии подробно рассмотрено множество химических реакций, характерных для α-амино- и α-карбоксильных групп аминокислот (ацилирование, алкилирование, нитрование, этерификация и др.). Здесь будут рассмотрены общие цветные реакции для обнаружения индивидуальных аминокислот и аминокислот, входящих в состав белков, основанные на химической природе радикалов аминокислот (табл. 1.5).
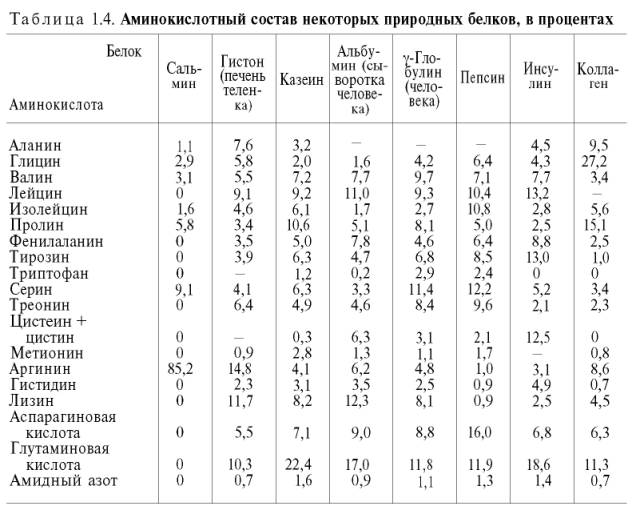
Для открытия в биообъектах и количественного определения аминокислот успешно применяется реакция их с нингидрином. На I стадии реакции образуется восстановленный нингидрин за счет окислительного дезаминирования аминокислот (параллельно происходит декарбоксилирование аминокислот):
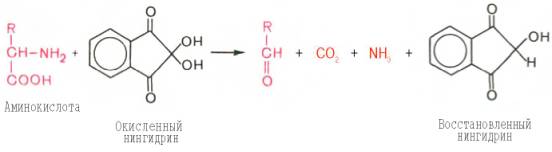
На II стадии образовавшийся аммиак реагирует с эквимолярными количествами окисленного и восстановленного нингидрина, образуя сине-фиолетовый продукт, интенсивность окраски которого (при 570 нм) пропорциональна количеству аминокислоты:
На основе нингидриновой реакции были разработаны методы количественного определения аминокислот, в частности метод распределительной хроматографии на бумаге, впервые внедренный в 1944 г. (А. Мартин и Р. Синдж). Эта же реакция используется благодаря своей высокой чувствительности в автоматическом анализаторе аминокислот. Впервые такой прибор сконструировали Д. Шпакман, С. Мур и У. Стейн (рис. 1.7). После разделения смеси аминокислот в колонках, заполненных специальными ионообменными смолами (сульфополистирольный катионит), ток элюента из колонки поступает в смеситель, туда же поступает раствор нингидрина; интенсивность образующейся окраски автоматически измеряется на фотоэлектроколориметре и регистрируется самописцем. Этот метод нашел широкое применение в клинической практике при исследовании крови, мочи, спинномозговой жидкости. С его помощью за 2–3 ч можно получить полную картину качественного состава аминокислот в биологических жидкостях и выявить наличие в них необычных азотсодержащих веществ, что имеет важное диагностическое и прогностическое значение.
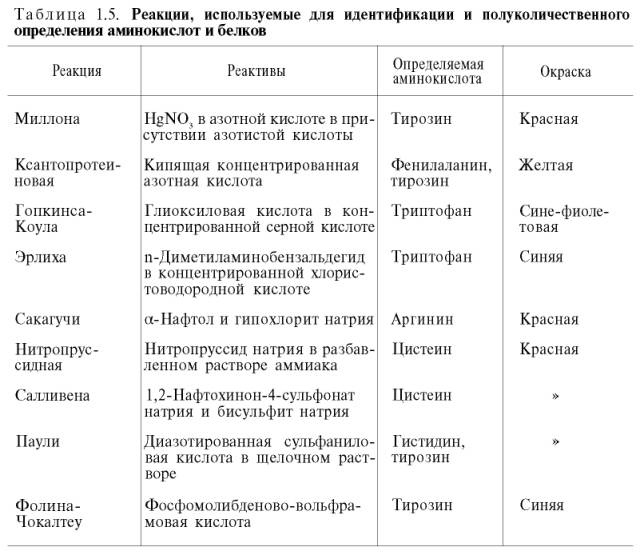
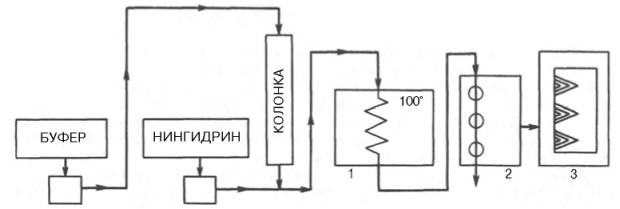
Рис. 1.7.Работа автоматического анализатора аминокислот (принципиальная схема
по Шпакману, Муру и Стейну).
1 - смеситель; 2 - фотоэлектроколориметр; 3 - самописец.
Автоматические анализаторы аминокислот все время совершенствуются, повышаются чувствительность методов и скорость проведения анализа. Так, в современных приборах высокоэффективной жидкостной хроматографии (ВЭЖХ) удается проводить анализ гидролизата белка за 45 мин, определяя при этом концентрацию аминокислот в пикомолях (рис. 1.8).
Смесь аминокислот может быть успешно разделена также методом электрофореза на бумаге. При рН 6,0 возможно хорошее разделение кислых и основных аминокислот с нейтральными. В этом случае отрицательно заряженные (кислые) аминокислоты будут двигаться к аноду, а положительно заряженные – к катоду. Нейтральные аминокислоты остаются на линии старта.
Для их разделения электрофорез обычно проводят при рН 1,8–2,0, когда все они мигрируют к аноду с незначительным, но уловимым различием в подвижности. После электрофореза местоположение аминокислот на электофореграмме выявляют с помощью химических реакций, а после элюции окрашенных продуктов определяют их количественно.
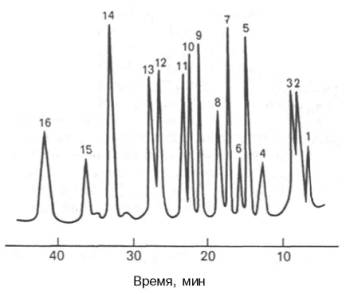
Рис. 1.8.ВЭЖХ аминокислот по Цеху и Вольтеру. Разделение на колонке (3 х 250 мм), наполненной ионообменной смолой – полистиролдивинилбензолом. Концентрация аминокислот 500 пмоль/л, реактив для детектирования – флюорескамин, образующий с аминогруппой сильно флюоресцирующее соединение.
1 - Асп; 2 - Тре; 3 - Сер; 4 - Глу; 5 - Гли; 6 - Ала; 7 - Цис; 8 - Вал; 9 - Мет; 10 -Иле; 11 - Лей; 12 - Тир; 13 - Фен; 14 -Лиз; 15 - Гис; 16 - Арг.
СТРУКТУРЫ БЕЛКОВ
ПЕРВИЧНАЯ
Первичная структура белка – это число и последовательность аминокислотных (АК) остатков, соединённых друг с другом пептидными связями.
Первые исследования по выяснению аминокислотных последовательностей белков были выполнены в Кембриджском университете Фредериком Сенгером , дважды нобелевским лауреатом (1958,1980) Работал с гормоном инсулина 10 лет. Было установлено, что в молекулу инсулина входит 51 аминокислотных остатков. Молекула состоит из двух полипептидных цепей, соединённых дисульфидными мостиками. В 1954 году нобелевскую премию получил Лайнус Поллинг (1953).. Он выявил, что организм человека состоит из 10 тыс. различных белков. Расшифровал геном человека.
АК последовательность белка строго определена генетическим кодом и определяет его биологические функции. Замена одной АК в молекуле белка может изменить все функции.
ВТОРИЧНАЯ
Вторичная структура белка представляет собой способ укладки полипептидной цепи в упорядоченную форму за счёт системы водородных связей.
Две формы вторичной структуры:
- спиральная (в пределах одной полипептидной цепи)
- слоисто-складчатая (за счет водородных связей между смежными полипептидными цепями)
Спираль (α-спираль) – сохраняет форму за счёт многочисленных водородных связей между находящимися рядом СО и NН группами.
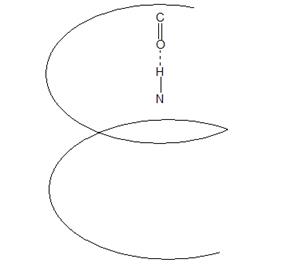
Витки спирали регулярны. В одном витке α-спирали 3, 6 АК-остатка, каждая пептидная группа образована водородной связью, с четвёртой от неё пептидной группой. α-спираль – устойчива.
Белковая молекула может иметь и другой вид – складчатый. В этом случае связываются водородной связью две антипараллельные соседние цепи (против «N» - конца одной полипептидной цепи стоит «С» - конец второй). Водородные связи перпендикулярны цепям и эта конфигурация (β-складчатый слой) прочна на разрыв, гибка (фиброин шёлка, волосы).
Белок коллаген состоит из трёх полипептидных цепей, свитых вместе, которые образуют тройную спираль. Такой белок невозможно растянуть (в сухожилиях, костных тканях). При закручивании полипептидной цепи в спираль радикалы АК- остатков направлены наружу от цепи и они могут взаимодействовать между собой, формируя третичную структуру – глобулу или фибриллу.
ТРЕТИЧНАЯ
Третичная структура - ещё более высокая организация белковых молекул. Она даёт представление об объёмной форме и взаимном расположении участков белковой молекулы. Глобула – это свернувшаяся в клубок спираль, которая поддерживается за счёт водородных, ионных, ковалентных (дисульфидных) связей, гидрофобных взаимодействий между боковыми неполярными радикалами АК. Спирали могут компактно укладываться в пучки, которые также удерживаются вышеперечисленными связями
 С=О Н—N водородная связь
С=О Н—N водородная связь
—S ———————— S— ковалентная связь
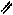
 —NH3+ –O—C— ионная связь
—NH3+ –O—C— ионная связь
О
— R R — гидрофобное взаимодействие за счет сил Ван-дер-Ваальса.
В количественном отношении при формировании третичной структуры более важны гидрофобные взаимодействия. Белки сворачиваются таким образом, чтобы его гидрофобные боковые цепи были скрыты от взаимодействия с водой, а гидрофильные – высовывались наружу.
ЧЕТВЕРТИЧНАЯ (характерна для для глобулярных белков)
Образуется при взаимодействии нескольких белковых глобул, образующих субъединицу за счёт водородных и ионных связей.
Субъединица Гемоглобина состоит из четырёх отдельных полипептидных цепей двух типов : двух α-цепей и двух β-цепей. Две α-цепи содержат по 141 АК-остатку, β-цепи содержат по 146 АК-остатков.
Молекулярная формула гемоглобина С3032Н4816О172N780S8Fe4
СВОЙСТВА БЕЛКОВ
ЭЛЕКТРИЧЕСКИЕ
Молекула белка имеет значительное число положительных и отрицательных зарядов на своей поверхности. Поэтому белки обладают амфотерными свойствами и каждый их них обладает изоэлектрической точкой, то есть значение рН при которой молекула нейтральна.
При рН, лежащем ниже изоэлектрической точки (кислая среда), суммарный заряд - положительный. При рН, лежащем выше - суммарный заряд отрицательный.
Обычно все молекулы белка заряжены одинаково. В результате возникает взаимное отталкивание, препятствующее их слипанию. В изоэлектрической точке отталкивания нет, молекула слипается, растворимость белка минимальна.
Например, у свежего молока значение рН лежит выше изоэлектрической точки белка казеина (щелочная среда), когда же молоко прокисает за счёт подкисления молока кислотой в результате деятельности молочнокислых бактерий, его рН начинает падать и достигает изоэлектрической точки казеина при рН=4,7. Казеин при этом выпадает в осадок, молоко створаживается.
ДЕНАТУРАЦИЯ БЕЛКА
Денатурация – это утрата белком его природной структуры при разрушении нековалентных связей. Денатурация может быть: обратимой, необратимой, полной и частичной. Степень денатурации зависит от интенсивности разрушающего фактора и природы белка. Сначала разрушается четвертичная структура, затем третичная, потом вторичная. Первичная структура при денатурации остаётся.
Вызывать денатурацию могут:
- нагревание или действие излучения. Кинетическая энергия, сообщённая белку вызывает сильную вибрацию атомов, водородные и ионные связи при этом разрываются. Белок свёртывается.
- действие сильных электролитов: кислот, щелочей, концентрированных растворов солей. Они разрушают ионные связи. При длительном воздействии могут разрывать даже пептидные связи, то есть разрушать первичную структуру.
- действие солей тяжёлых металлов. Катионы металлов образуют прочные связи с карбоксильными ионами, вследствие чего происходит разрыв ионной связи. Они также нейтрализуют отрицательный заряд белковой молекулы, уменьшают его растворимость, и таким образом вызывают выпадение белка в осадок.
- органические растворители и детергенты (ПАВ). Эти вещества разрушают гидрофобные связи, образуя связи с гидрофобными неполярными группами. Так, использование спирта в качестве дезинфицирующего средства основано на денатурации белка любых присутствующих бактерий.
Так как укладка белковой молекулы зависит от первичной структуры белка, то
денатурация может быть обратимой, когда разрушенные связи могут восстановиться или же может произойти перезарядка белковой молекулы, и осадок может раствориться. Это подтверждается, например, при восстановлении активности рибонуклеазы (фермента, разрушающего РНК). Если после полной денатурации положить рибонуклеазу в солевой раствор, она принимает первичную форму.
