Опыт 4. Получение йодоформа из этилового спирта
Лабораторная работа №7
Галогенпроизводные углеводородов
Цель: экспериментальное получение и изучение свойств галогенпроизводных углеводородов.
Опыт 1. Получение бромистого этила.
Реактивы и материалы: этиловый спирт; бромид калия (порошок); серная кислота (d = 1,84 г/см3).
В пробирку с отводной трубкой помещают 3 капли спирта, 2 капли воды и 3 капли серной кислоты. Охладив разогревшуюся спирто-кислотную смесь, в нее помещают на конце микролопатки несколько кристаллов бромида калия.
Пробирку укрепляют наклонно в лапке штатива и осторожно нагревают содержимое пробирки до кипения. Конец отводной трубки погружают в другую пробирку, содержащую 6-7 капель воды и охлаждаемую льдом.
Нагревание ведут до исчезновения кристаллов бромида калия в реакционной пробирке. В приемнике образуется два слоя: нижний – бромистый этил, верхний – вода. С помощью пипетки удаляют верхний слой.
Стеклянной палочкой вносят 1 каплю бромистого этила в пламя горелки. Пламя окрашивается по краям в зеленый цвет.
Химизм процесса:
С2Н5ОН + НО—SO3Н → С2Н5 – О – S03H + Н2О
этилсерная кислота
КВr + H2SO4 → НВr + KHSO4
гидросульфат калия
С2Н5 – О – S03H + HBr → C2H5Br + H2SO4
бромистый этил
Наиболее удобным способом получения галогеналкилов является замещение гидроксильной группы спиртов R—ОН на галоген. Получение галогенопроизводных из спиртов применяется в больших масштабах, так как спирты – легкодоступные и хорошо изученные соединения. В некоторых случаях при получении галогеналкилов вместо галогеноводородов применяют галогениды фосфора.
Опыт 2. Получение хлористого этила.
Реактивы и материалы: этиловый спирт; серная кислота (d = 1,84 г/см3).
В пробирку насыпают мелкие кристаллы хлорида натрия (слой высотой 1 мм), затем добавляют 3 капли этилового спирта, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки.
Время от времени подносят отверстие пробирки к пламени горелки. Выделяющийся хлористый этил загорается, образуя характерное колечко, окрашенное в зеленый цвет.
Химизм процесса:
С2Н5ОН + НО—SO3Н → С2Н5 – О – SO3H + Н2О
NaCl + H2SO4 → HCl + NaHSO4
С2Н5 – О – SO3H + HCl → C2H5Cl + H2SO4
Хлористый этил — газ, легко сгущается в жидкость с т. кип. 12,4°С.
Опыт 3. Определение хлора действием металлического натрия на спиртовой раствор органического вещества (метод А. В. Степанова).
Реактивы и материалы: хлороформ; этиловый спирт; металлический натрий; нитрат серебра, 0,1 н. раствор; азотная кислота, 0,1 н. раствор.
В пробирку помещают 3 капли хлороформа, 3 капли этилового спирта и взбалтывают. Затем вводят в раствор кусочек металлического натрия величиной со спичечную головку. Смесь в пробирке начинает бурно кипеть, и для охлаждения пробирку погружают в холодную воду.
Жидкость в пробирке мутнеет или из нее выпадает осадок плохо растворимого в спирте хлорида RC1. По окончании выделения пузырьков водорода проверяют, полностью ли растворился металлический натрий. Если натрий растворился, приливают к смеси 3-4 капли дистиллированной воды и добавляют разбавленную азотную кислоту до кислой реакции.
Затем прибавляют 2-3 капли раствора нитрата серебра – выпадает белый творожистый осадок хлорида серебра.
Химизм процесса:
2С2Н5ОН + 2Na → 2C2H5ONa + Н2
этилат натрия
RC1 + 2H+ → R-H + HC1
углеводород
R-Cl + C2H5ONa → R-O-C2H5 + NaCl
простой эфир
HC1 + C2H5ONa → C2H5OH + NaCl
NaCl + AgNO3 → AgCl + NaNO3
Реакцию образования нерастворимых серебряных солей галогеноводородных кислот при действии азотнокислого серебра непосредственно нельзя использовать для определения галогена в органических соединениях, так как они не диссоциируют на ионы и в растворе нет ионов галогена.
Необходимо сначала перевести галоген в неорганическое соединение – в данном случае хлорид натрия. При действии водорода в момент выделения происходит отщепление галогена.
Опыт 4. Получение йодоформа из этилового спирта.
Реактивы и материалы: этиловый спирт; едкий натр, 2 н. раствор; раствор йода в йодиде калия. Оборудование: микроскоп; предметное стекло.
В пробирку помещают 1 каплю этилового спирта, 3 капли раствора йода в иодиде калия и 3 капли раствора едкого натра. Содержимое пробирки нагревают, не допуская закипания раствора, так как в кипящем растворе йодоформ расщепляется щелочью.
Появляется беловатая муть, из которой постепенно при охлаждении образуются кристаллы йодоформа. Если муть растворяется, то добавляют еще 3-4 капли раствора йода к теплой реакционной смеси и тщательно перемешивают содержимое, пока не начнется выделение кристаллов.
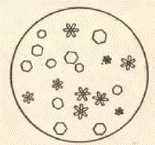 Две капли осадка переносят на предметное стекло и рассматривают их под микроскопом (рис. 5). Кристаллы йодоформа имеют вид шестиугольников или шестиконечных снежинок. Химизм процесса:
Две капли осадка переносят на предметное стекло и рассматривают их под микроскопом (рис. 5). Кристаллы йодоформа имеют вид шестиугольников или шестиконечных снежинок. Химизм процесса:
I2 + 2NaOH → NaOI + NaI + Н2O Рис. 4.
NaOI → NaI + [О]
CH3CH2OH + [O] → CH3COH + H2O
CH3COH + 3I2 → CI3COH + 3HI
CI3COH + NaOH → CHI3 + HCOONa
Йодоформ образует кристаллы желтого цвета с температурой плавления 119°С, обладает сильным, очень навязчивым запахом. Это прекрасный антисептик.
Опыт 5. Получение бромбензола.
Реактивы и материалы: бензол; бром; железо (опилки); натронная известь; едкий натр, 2 н. раствор. Оборудование: пробирка с плотно вставленной изогнутой отводной трубкой: стеклянная трубка-поглотитель; ватный тампон; водяная баня, термометр.
Специальное указание: опыт проводят в вытяжном шкафу!
 В сухую пробирку помещают немного железных опилок, 5 капель бензола и 2 капли брома. Отверстие пробирки сразу же закрывают пробкой с газоотводной трубкой, к которой прикреплена стеклянная трубка-поглотитель с натронной известью (рис.5). Рис. 5.
В сухую пробирку помещают немного железных опилок, 5 капель бензола и 2 капли брома. Отверстие пробирки сразу же закрывают пробкой с газоотводной трубкой, к которой прикреплена стеклянная трубка-поглотитель с натронной известью (рис.5). Рис. 5.
Реакция начинается немедленно, смесь при этом почти не разогревается. После того как в реакционной пробирке прекратится выделение пузырьков НВr и исчезнут окрашенные пары брома, ее помещают в водяную баню и нагревают 2 мин при температуре 60-700С.
Полученный бромбензол охлаждают и промывают от следов брома раствором едкого натра почти до обесцвечивания. Верхний водный слой отбирают при помощи пипетки. С бромбензолом проводят качественную реакцию на галоген. Химизм процесса:
2Fe + ЗВr2 →2FeBr3
FeBr3
С6Н6 + Вr2 → С6Н5Вr + НВr
