Гальванические элементы
В отличие от гомогенных реакций, протекающих во всем объеме системы, гетерогенные взаимодействия осуществляются на границе раздела фаз.
Процессы взаимного превращения химической и электрической форм энергии называются электрохимическими процессами.
Рассмотрим процессы, протекающие при погружении металла в воду или раствор соли данного металла, в качестве примера гетерогенного взаимодействия.
Так как совершенно нерастворимых веществ не существует, то любой металл хотя бы в ничтожной степени растворяется в воде. При этом в раствор переходят положительно заряженные ионы металла Меn+, а в самом металле остаются электроны, в результате чего металл заряжается отрицательно. Уравнение, отражающее процесс ионизации атомов металла под действием полярных молекул воды имеет вид:
Ме0+ m H2O Û [Me(H2O)m]n+ + ne– (29)
в растворе в кристалле Ме
Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате чего образуется двойной электрический слой. На границе раздела раствора соли с металлом возникает определенная разность потенциалов, которая называется электродным потециалом – ЕМе/Меn+ [В].
Абсолютное значение электродного потенциала измерить невозможно. Поэтому измеряют разность потенциалов между данным электродом и стандартным водородным электродом, потенциал которого условно принимают равным нулю: Е02Н+/Н2 = 0В. Электродный потенциал, измеренный по отношению к стандартному водородному электроду в стандартных условиях (Т = 250C (298 К), Р = 1 атм, СМеn+ = 1 моль/л), называется стандартным электродным потенциалом(обозначается Е0).
Зависимость электродного потенциала от природы металла, температуры и концентрации ионов металла выражается уравнением Нернста:
Е=Е0 + (RT/nF)lg CMen+, (30)
Где (RT/F)=0,059 при Т=298 К. Тогда уравнение принимает вид:
ЕМеn+/Me0=Е0 Меn+/Me0 + (0,059/n)lg CMen+, (31)
Е0 Меn+/Me0 – стандартный электродный потенциал Ме;
n – число электронов, участвующих в электродном процессе;
CMen+ - концентрация ионов металла, моль/л (молярная концентрация).
В зависимости от величины Е0 Меn+/Me0 все металлы можно расположить в ряд, который называется ряд стадартных электродных потенциалов металлов (табл. 4). В этом ряду (слева направо) величина электродного потенциала возрастает, при этом восстановительная способность металлов уменьшается, а окислительная способность ионов металлов увеличивается.
Таблица 4
Ряд стандартных электродных потенциалов металлов
| Восст.форма | Li | K | Na | Mg | Zn | Fe | Ni | Pb | H2 | Cu | Ag | Au |
| Окисл.форма | Li+ | K+ | Na+ | Mg2+ | Zn2+ | Fe2+ | Ni2+ | Pb2+ | 2H+ | Cu2+ | Ag+ | Au3+ |
| ЕМе/Меn+, В | -3,04 | -2,92 | -2,71 | -2,36 | -0,76 | -0,44 | -0,25 | -0,13 | +0,34 | +0,80 | +1,50 |
Этот ряд характеризует химические свойства металлов:
Металлы, обладающие более отрицательным электродным потенциалом, способны вытеснять менее активные металлы (т.е. имеющие более положительные электродные потенциалы) из растворов их солей.
Металлы, имеющие более отрицательный электродный потенциал по отношению к водородному, вытесняют водород из кислот – HCl (разб. и конц.) и H2SO4 (разб.), так как окислителем в них является ион H+.
По восстановительной активности все металлы делят на три группы:
1) активные металлы: Е0 Меn+/Me0< -1В;
2) металлы средней активности: -1В < Е0 Меn+/Me0 <0 В;
3) малоактивные металлы: Е0 Меn+/Me0 >0 В.
В концентрированной серной кислоте H2SO4 (конц.) роль окислителя выполняет анион SO42- за счет иона S+6, который является более сильным окислителем, чем H+. Взаимодействие металлов с ней протекает по схеме:
Me0 + H2S+6O4 (конц.) = Me2+n (SO4)n + H2O + S+4O2 – для малоактивных металлов;
Me0 + H2S+6O4 (конц.) = Me2+n(SO4)n + H2O +S0 – для металлов средней активности;
Me0 + H2S+6O4 (конц.) = Me2+n(SO4)n + H2O + Н2S–2 – для активных металлов.
В азотной кислоте любой концентрации окислителем является анион NO3- за счет иона N+5. При взаимодействии HNO3 (конц.) с металлами она восстанавливается до иона N+4, образуя газ NO2, независимо от активности металла. При взаимодействии HNO3 (разб.) с металлами взаимодействие протекает по схеме:
Me0 + HN+5O3 (разб.) = Me+n (NO3)n + H2O + N+2O – для малоактивных металлов;
Me0 + HN+5O3(разб.)= Me+n (NO3)n+ H2O+ N2+1O – для металлов средней активности;
Me0 + HN+5O3(разб.)= Me+n (NO3)n+ H2O + N-3H4NO3 – для очень активных металлов.
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР. Гальванический элемент состоит из двух металлических электродов (анода и катода): пластин, изготовленных из разных металлов и погруженных в растворы своих солей. ГЭ имеет две цепи: внешнюю – металлический проводник, соединяющий пластины, по которому двигаются электроны от анода к катоду, и внутреннюю – электролитический ключ, соединяющий растворы солей, по которому двигаются ионы в направлении от катода к аноду.
Максимальная разность потенциалов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой гальванического элемента (ЭДС) – Еэдс [В]: Еэдс= Еок – Евос или Еэдс= Ек – Еа.




 Для рассмотрения электрохимического процесса, лежащего в основе работы любого гальванического элемента, следует использовать алгоритм, предложенный в примерах решения задач. Необходимо помнить, что в ГЭ анодом является металл с большей восстановительной активностью, т.е. с меньшим значением электродного потенциала, а катодом – металл с меньшей восстановительной активностью, т.е. с более высоким значением электродного потенциала. При написании уравнений электродных процессов следует учитывать, что более активный металл является восстановителем, а ион менее активного металла – окислителем.
Для рассмотрения электрохимического процесса, лежащего в основе работы любого гальванического элемента, следует использовать алгоритм, предложенный в примерах решения задач. Необходимо помнить, что в ГЭ анодом является металл с большей восстановительной активностью, т.е. с меньшим значением электродного потенциала, а катодом – металл с меньшей восстановительной активностью, т.е. с более высоким значением электродного потенциала. При написании уравнений электродных процессов следует учитывать, что более активный металл является восстановителем, а ион менее активного металла – окислителем.
Примеры решения задач
Пример 1. Вычислите ЭДС и определите направление тока во внешней цепи данного гальванического элемента:
Fe │FeSO4║AgNO3│Ag, учитывая, что концентрация ионов Fe2+ и Ag+ соответственно равна 0,1моль/л и 0,01моль/л.
Р е ш е н и е. 1) Составляем схему гальванического элемента и указываем концентрацию ионов Fe2+ и Ag+ в растворах электролитов:
Fe │FeSO4║AgNO3│Ag
C Fe2+ = 10-1 моль/л и С Ag+ = 10-2 моль/л.
2) Пользуясь уравнением Нернста, вычисляем значения электродных потенциалов железа и серебра в растворах заданной концентрации:
EFe2+/Fe0 = E0 Fe2+/Fe0 + (0,059/2) lg CFe2+ = – 0,44 + (0,059/2) lg10-1 = – 0,47B,
EAg+/Ag0 = E0 Ag+/Ag0 + 0,059) lg CAg+ = + 0,80 + 0.059 lg10-2 = + 0,68 В
EFe2+/Fe0 < EAg+/Ag0, следовательно, более активным металлом является железо, оно будет отрицательным электродом – анодом, а серебро – катодом.
Таким образом, Fe – анод (А) и Fe – восстановитель, Ag – катод.
3) Указываем направление движения электронов во внешней цепи, учитывая, что электроны движутся от анода к катоду:
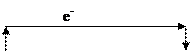
(–)Fe │FeSO4║AgNO3│Ag(+)
4) Составляем электронные уравнения процессов, протекающих на электродах, учитывая, что на аноде происходит окисление атомов железа, а на катоде – восстановление ионов серебра:
(-) (А) Fe0 – 2e– → Fe2+ 1– процесс окисления
(+) (K) Ag+ + e– → Ag0 2 – процесс восстановления
Fe0 +2 Ag+ → Fe2+ +2 Ag0
5) Записываем молекулярное уравнение окислительно-восстановительной реакции, лежащей в основе работы гальванического элемента:
Fe0 + 2AgNO3 → Fe(NO3)2 + 2Ag0↓
6) Рассчитываем ЭДС гальванического элемента:
Еэдс = ЕК – ЕА = E Ag+/Ag0 – E Fe2+/Fe0 = 0,68 – (–0,47) = 1,15 В.
Пример 2. Будет ли магний взаимодействовать с раствором сульфата никеля.
Р е ш е н и е. Для решения этой задачи необходимо сравнить стандартные электродные потенциалы магния и никеля:
E0Mg2+/Mg0 = – 2,34В, E0Ni2+/Ni0 = – 0,25В
Магний – металл, имеющий более отрицательное значение стандартного электродного потенциала и поэтому являющийся более сильным восстановителем. Следовательно, магний будет подвергаться окислению под действием ионов никеля, и электроны от магния будут переходить к никелю:
Mg0 – 2e– → Mg2+
Ni2+ +2e– → Ni0
Mg0 + Ni2+ → Mg2+ + Ni0
Mg + NiSO4 = MgSO4 + Ni
1.13. Коррозия металлов
Коррозия– разрушение металла под воздействием окружающей среды.
Это самопроизвольный окислительно-восстановительный процесс, протекающий на границе раздела фаз. По механизму протекания коррозия подразделяется на химическую (протекает в средах, не проводящих электрический ток) и электрохимическую (протекает в средах, проводящих электрический ток).
Основные причины электрохимической коррозии (ЭХК) – наличие в металле примесей других металлов и контакт металла с другими металлами, отличающимися по активности. Согласно теории ЭХК при соприкосновении металла с раствором электролита на его поверхности возникает множество гальванических микроэлементов. При этом анодами являются частицы основного металла, катодами – примеси, с большим значением электродного потенциала.
Одной из особенностей электрохимической коррозии является ее многостадийность. Рассмотрим процесс коррозионного разрушения металла на примере коррозионного гальванического элемента, возникающего при контакте железа и меди: Fe ê электролит ê Cu. Для того, чтобы понять, какой из этих двух металлов будет подвергаться коррозии, необходимо сравнить значения их стандартных электродных потенциалов: E0Fe2+/Fe0 = – 0,44В, E0 Cu2+/Cu0 = + 0,34В.
E0Fe2+/Fe0 < E0 Cu2+/Cu0, следовательно, железо является более активным восстановителем: Fe – анод (А), Cu – катод (К).
На первой стадии происходит окисление более активного металла (анодный процесс) и переход образовавшихся ионов в раствор: Fe0 – 2e- =Fe2+
Вторая стадия – перенос электронов от анода к катоду, который при этом заряжается отрицательно, т.е. поляризуется.
На третьей стадии происходит процесс восстановления (катодный процесс), в котором участвует окислитель окружающей среды. Он “забирает” электроны у катода, т.е. снимает с него отрицательный заряд и, таким образом, деполяризует катод. Процесс отвода электронов с катода называется деполяризацией, а окислитель – деполяризатором.
Важнейшими окислителями, вызывающими ЭХК, являются ионы водорода и растворенный в воде молекулярный кислород. В связи с этим различают два вида электрохимической коррозии: с водородной и с кислородной деполяризацией.
Электрохимическая коррозия с водородной деполяризациейпротекает в кислой среде.Коррозионному разрушению подвергаются металлы, удовлетворяющие условию: Е0Меn+/Ме0 < Е0 2Н+/Н20 (Е0 2Н+/Н20 =0).
Электрохимическая коррозия с кислородной деполяризациейпротекает в нейтральной (влажный воздух, морская вода, влажные почвы) или щелочной средах. Коррозионному разрушению подвергаются металлы, стандартный электродный потенциал которых меньше стандартного электродного потенциала кислорода:
Е0Меn+/Ме0 < Е0 О2 /2Н2О (Е0 О2 /2Н2О = 1,23В).
 При рассмотрении механизма электрохимической коррозии следует использовать алгоритм, приведенный в примерах решения задач.
При рассмотрении механизма электрохимической коррозии следует использовать алгоритм, приведенный в примерах решения задач.
Для защиты металлов от коррозии используют различные виды защитных покрытий, в том числе металлические покрытия. Анодное покрытие – покрытие основного металла более активным металлом, т.е. Е0осн.Ме > Е0покр.Ме (например, покрытие железа цинком). Катодное покрытие – покрытие основного металла менее активным, т.е. Е0осн. Ме < Е0 покр. Ме (например, покрытие железа никелем).
Примеры решения задач
Пример 1. Алюминий находится в контакте с цинком. Какой из этих металлов будет окисляться, если эта пара попадет в кислую среду, например, в среду соляной кислоты?
Р е ш е н и е. Из условия задачи следует что металлы находятся в кислой среде – растворе HCl. Раствор HCl – электролит, т.е. электропроводящая среда, следовательно, будет протекать электрохимическая коррозия. Для рассмотрения механизма коррозии воспользуемся предложенным выше алгоритмом.
1) Составим схему коррозионной гальванопары:
Al │ HCl │ Zn
2) Укажем окислитель. Среда кислая, поэтому окислителем (деполяризатором) является ион водорода H+. Следовательно, в этой схеме будет протекать электрохимическая коррозия с водородной деполяризацией.
3) Определим, какой из металлов будет являться анодом, а какой – катодом. Для этого сравним значения стандартных электродных потенциалов алюминия и цинка:
Е0Al3+/Al0= – 1,6 B < E0Zn2+/Zn0= – 0,77 B,
Значит, алюминий – более активный металл, он является восстановителем и анодом, а цинк – катодом: Al – анод (А), Zn – катод (К).
4) Укажем направление движения электронов, учитывая, что электроны движутся от анода к катоду, а от катода – к окислителю окружающей среды:
 |
(-) Al│HCl│Zn(+)
5) Запишем электронные уравнения процессов, протекающих на электродах, и составим суммарное уравнение:
 (–)(A) Al0 – 3e– → Al3+ 2
(–)(A) Al0 – 3e– → Al3+ 2
(+)(K) 2Н+ + 2е– → Н2↑ 3
2Al0 +6H+ → 2Al3+ + 3H2↑
6) Составим молекулярное уравнение окислительно-восстановительной реакции, протекающей при коррозии: 2Al + 6HCl → 2AlCl3 + 3H2↑
7) Запишем вывод: при коррозии алюминия, находящегося в контакте с цинком, окисляется алюминий. Продуктом его коррозии является соль – хлорид алюминия. На цинковом катоде выделяется водород.
Пример 2. Изделие из меди с оловянным покрытием находится во влажном воздухе. Какой из металлов будет корродировать при нарушении целостности покрытия? К какому типу покрытий относится в этом случае олово?
Р е ш е н и е. Изделие находится во влажном воздухе, который является электропроводящей средой, следовательно, будет протекать электрохимическая коррозия.
1) Составим схему коррозионного гальванического элемента:
Sn │ H2O │ Cu
2) Укажем окислитель. Вода – это нейтральная среда, поэтому окислителем (деполяризатором) является кислород – О2. Следовательно, в этой схеме будет протекать электрохимическая коррозия с кислородной деполяризацией.
3) Определим, какой из металлов будет являться анодом, а какой – катодом. Для этого сравним значения стандартных электродных потенциалов олова и меди:
Е0Sn 2+/ Sn0= – 0,14 B < E0Cu2+/Cu0= + 0,34 B.
Значит, олово – более активный металл, оно является восстановителем и анодом, а медь – катодом: Sn – анод (А), Cu – катод (К).
4) Укажем направление движения электронов, учитывая, что электроны движутся от анода к катоду, а от катода – к окислителю среды:
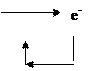 |
(–) Sn │H2O │ Cu (+)
5) Запишем электронные уравнения процессов, протекающих на электродах, и составим суммарное уравнение. При написании уравнения катодного процесса следует учитывать, что процесс восстановления протекает в присутствии воды:
 (-)(A) Sn0 – 2e– → Sn2+ 2
(-)(A) Sn0 – 2e– → Sn2+ 2
(+)(K) O2 + 2H2O + 4е– →4OН– 1
2Sn0 +2O2 + 2H2O → 2Sn2+ +4OH–
6) Составим молекулярное уравнение окислительно-восстановительной реакции, протекающей при коррозии: 2Sn0 +2O2 + 2H2O → 2 Sn(OH)2
7) Запишем вывод: по отношению к меди олово является анодным покрытием, так как в этой паре олово выступает в роли анода. При нарушении целостности покрытия корродировать будет олово. Продуктом его коррозии является основание – гидроксид олова.
Пример 3. Медная деталь разрушается в атмосфере кислорода при температуре 2000С. В чем заключается причина этого явления?
Р е ш е н и е. 1) Определяем характер среды: атмосфера кислорода (О2) при высокой температуре (2000С) – это неэлектропроводящая среда. Следовательно, будет происходить химическая коррозия.
2) Запишем уравнение процесса, протекающего при химической коррозии медной детали:
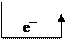 Cu0 + O20 = 2CuO
Cu0 + O20 = 2CuO
Вывод: происходит окисление меди и на поверхности детали образуется оксидная пленка.
1.14.Электролиз
Электролиз – это совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую энергию.
Электролиз проводят в электролизере, который представляет собой емкость, заполненную раствором или расплавом электролита, в который погружены два электрода (например, графитовые) – катод и анод. Катод подсоединяют к отрицательному полюсу внешнего источника тока, а анод – к положительному. Таким образом, катод – отрицательно заряженный электрод, а анод – положительно заряженный электрод. На катоде происходит процесс присоединения электронов катода (от внешнего источника тока) катионами, атомами, молекулами. На аноде происходит процесс отдачи электронов аноду (во внешнюю цепь) анионами, атомами, молекулами. Таким образом, на катоде протекает процесс восстановления, на аноде – процесс окисления.
Рассмотрим механизм электролиза на примере расплава соли фторида натрия NaF. Расплавы солей являются сильными электролитами, поэтому при высоких температурах полностью диссоциируют на ионы в соответствии с уравнением процесса: NaF = Na+ + F.–
Под действием электрического тока ионы приобретают направленное движение: катионы будут двигаться к катоду, а анионы – к аноду. Достигнув электродов, ионы начнут разряжаться на их поверхности. На катоде будет происходить процесс  восстановления ионов Na+, а на аноде – процесс окисления ионов F–. Запишем электронные уравнения этих процессов и просуммируем их:
восстановления ионов Na+, а на аноде – процесс окисления ионов F–. Запишем электронные уравнения этих процессов и просуммируем их:
(К–): Na+ + e– → Na0 2 – процесс восстановления
(A+): 2F- – 2e– → F2 1 – процесс окисления
2Na+ + 2F- → Na0 + F2↑
Суммарное молекулярное уравнение электролиза:
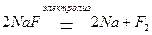
Электролиз водных растворов электролитов осложняется участием в электродных процессах молекул воды. Алгоритм рассмотрения электролиза водных растворов солей приведен в примерах решения задач.
При электролизе водных растворов электролитов необходимо учитывать особенности катодных и анодных процессов:
1. Катионы металлов от Li+ до Al3+ включительно (Е0Меn+/Ме0 < – 1,66 В) не восстанавливаются на катоде, вместо них на катоде восстанавливаются молекулы воды в соответствии с уравнением реакции: 2Н2О + 2е– = Н2 + 2ОН–
2. Катионы металлов от Mn2+ до H, восстанавливаются на катоде вместе с молекулами воды: Меn+ + ne– = Me0 ; 2Н2О + 2е– = Н2 + 2ОН–
3. Катионы металлов от Cu2+ до Au3+ полностью восстанавливаются на катоде в соответствии с уравнением реакции: Меn+ + ne– Me0
Если водный раствор электролита содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения значений стандартных электродных потенциалов металлов.
4. На практике используют два типа анодов: инертные или нерастворимые (уголь, графит, золото, платина) и активные или растворимые (Cu, Ag, Ni, Zn и др). Инертные электроды не участвуют в процессе электролиза. Активные аноды сами участвуют (окисляются) в процессе электролиза в соответствии с уравнением реакции: Ме0 – ne– = Men+.
5. Анионы кислородсодержащих кислот (SO42-, NO3-, CO32-, PO43-), в которых центральный атом (S+6, N+5, C+4, P+5).находится в высшей степени окисления, а также ионы F– никогда не окисляется на аноде из водных растворов электролитов. Вместо них окисляются молекулы воды: 2Н2О – 4е– = О20 + 4Н+
Количественные соотношения между массой выделившихся на электродах веществ и количеством прошедшего электричества через раствор или расплав электролита выражают законом Фарадея:
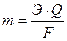 , (32)
, (32)
где m – масса вещества, выделившегося на электроде;
Э – его химический эквивалент;
Q – количество электричества (Кл);
F – число Фарадея (F= 96500 Кл).
Q = I·t, где I – сила тока (А), t – время электролиза (с).
Э=А/n, где А – атомная масса элемента; n – степень окисления его в соединении.
Тогда выражение (31) примет вид:
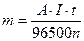 (33)
(33)
При электролизе в реальных условиях масса выделившегося вещества (его практический выход) всегда меньше массы вещества, рассчитанной по закону Фарадея. Это объясняется тем, что наряду с основными электродными процессами протекают побочные процессы, на которые расходуется часть количества электричества. Поэтому вводится понятие «выход по току»:
Впт =mпр/mтеор×100%, (33)
где mпр – масса вещества, практически полученного в процессе электролиза;
mтеор - масса вещества, теоретически рассчитанная по закону Фарадея.
Примеры решения задач
Пример 1. Составить схему электролиза нитрата свинца с угольными электродами.
Р е ш е н и е. 1) Определим состав электролита. Для этого запишем уравнение электролитической диссоциации соли Pb(NO3)2:
Pb(NO3)2 = Pb2+ + 2NO3–
(nH2O) (nH2O)
То есть в растворе присутствуют гидратированные ионы Pb2+и NO3–, а также молекулы воды, представляющие собой диполи Н+– ОН-.
2) Составляем условную схему электролиза, на которой показываем распределение ионов в пространстве и ориентацию полярных молекул воды у поверхности электродов. При прохождении тока через раствор положительно заряженные ионы будут двигаться к катоду, отрицательно заряженные – к аноду; молекулы воды будут определенным образом ориентироваться у поверхности электродов: положительно заряженным полюсом диполя у катода, а отрицательно заряженным полюсом – у анода. Таким образом, у поверхности каждого из электродов на электродах будут скапливаться два сорта частиц: у катода – катионы Pb2+ и молекулы воды, а у анода – анионы NO3– и молекулы воды. Следовательно, на каждом из электродов будут протекать два конкурирующих процесса.
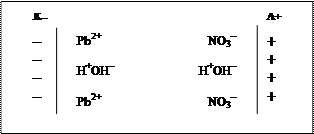
3) На основании сравнения значений стандартных электродных потенциалов определяем частицы, участвующие в катодном процессе (восстановления):
Е0Pb2+/Pb0 = – 0,13 B > Е0Н2О/Н2= –0,41 (–0,83) В, следовательно, ионы Pb2+ обладают большей окислительной активностью и поэтому они участвуют в катодном процессе в соответствии с уравнением реакции: Pb2+ + 2e– = Pb0
4) Определяем частицы, участвующие в анодном процессе (окисления).
Вспоминаем, что нитрат-ион относится к числу кислородсодержащих ионов, в котором центральный атом (N+5) находится в высшей степени окисления, поэтому ион NO3– не будет окисляться на аноде, вместо него окисляются молекулы воды:
2Н2О – 4е– = О20 + 4Н+
5) Составляем суммарное ионное, а затем – суммарное молекулярное уравнения процесса электролиза:
(K–): Pb2+ + 2e– → Pb0 2
(A+): 2Н2О – 4е– = О20 + 4Н+ 1
2Pb2+ + 2Н2О = 2Pb0 + О20 + 4Н+
2Pb(NO3)2 + 2Н2О = 2Pb0 + О20 + 4НNO3
Таким образом, при электролизе водного раствора Pb(NO3)2 с угольными электродами в процессе электролиза участвует как сам электролит, так и молекулы воды. Основными продуктами электролиза являются атомы свинца и молекулярный кислород, побочным продуктом является азотная кислота, накапливающаяся в прианодном пространстве.
Пример 2. Раствор содержит ионы Fe2+, Ag+, Bi3+, и Pb2+ одинаковой концентрации. В какой последовательности будут разряжаться эти катионы при электролизе, если напряжение достаточно для выделения любого металла?
Р е ш е н и е. При электролизе катионы разряжаются на катоде, где происходит процесс восстановления. Восстанавливаются ионы, обладающие окислительной активностью, которая тем выше, чем больше значение стандартного электродного потенциала. Следовательно, необходимо сравнить значения стандартных электродных потенциалов заданных ионов металлов:
Е0Fe2+/Fe0 = – 0,44В, Е0Ag+/Ag0 = 0,8В, Е0Bi3+/Bi0 = 0,21В, Е0Pb2+/Pb0 = – 0,13В
Сравниваем эти значения: Е0Ag+/Ag0 > Е0Bi3+/Bi0 > Е0Pb2+/Pb0 > Е0Fe2+/Fe0. Следовательно, в ряду Ag+ – Bi3+ – Pb2+ – Fe2+ окислительная активность уменьшается, поэтому легче всего восстанавливаются ионы Ag+, затем ионы Bi3+, далее – ионы Pb2+ и в последнюю очередь – ионы Fe2+. Восстановление ионов Fe2+ будет происходить совместно с молекулами воды.
Запишем электронные уравнения процессов, протекающих на катоде:
Ag+ + e– → Ag0 , Bi3+ + 3e– → Bi0 , Pb2+ +2 e– → Pb0 , Fe2+ + 2e– → Fe0
Пример 3. Написать уравнения реакций, протекающих на электродах при электролизе водного раствора хлорида никеля с никелевым анодом.
Р е ш е н и е. 1) Определяем состав электролита. Записываем уравнение электролитической диссоциации хлорида никеля: NiCl2 = Ni2+ + 2 Cl–
(nH2O) (nH2O)
2) Составляем условную схему электролиза (аналогичную схеме в задаче
№ 1), на которой показываем распределение ионов в пространстве и ориентацию полярных молекул воды у поверхности электродов. К катоду подходят катионы Ni2+ и молекулы воды, ориентированные положительным полюсом к поверхности катода; к аноду подходят анионы Cl– и молекулы воды, ориентированные отрицательным полюсом к поверхности анода.
3) Определяем, какие частицы будут участвовать в катодном процессе на основании сравнения значений стандартных электродных потенциалов:
(K–) Е0Ni2+/Ni0 = – 0,25 B, Е0Н2О/Н2 = – 0,41 (–0,83)В
Е0Ni2+/Ni0 > Е0Н2О/Н2, следовательно, ионы Ni2+ обладают большей окислительной активностью и поэтому они участвуют в катодном процессе в соответствии с уравнением реакции: Ni2+ + 2e– = Ni0
4) Определяем, какие частицы будут участвовать в анодном процессе. Для этого выписываем значения стандартных электродных потенциалов трех частиц: Cl-, H2O и Ni, поскольку материал анода также является химически активным:
(А+): Е0Cl2/2Cl- = + 1,36 В, Е0О2 / 2Н2O = + 1,23 ÷ (1,8)В , Е0Ni2+/Ni0 = – 0,25 B.
Сравнение значений Е0 показывает, что Е0Ni2+/Ni0 < Е0Cl2/2Cl-< Е0О2 / 2Н2O, поэтому большей восстановительной активностью обладают атомы никеля. Следовательно, сам никелевый анод будет участвовать в процессе окисления:
Ni0 – 2e– = Ni2+
5) Объединяем уравнения катодного и анодного процессов:
(K–) Ni2+ + 2e– = Ni0
(А+)Ni0 – 2e– = Ni2+
При суммировании получается 0 = 0, что лишено физического смысла. Поэтому рассмотрение электролиза завершают на этом этапе.
Таким образом, электролиз водного раствора NiCl2 с никелевым анодом сводится к анодному окислению атомов никеля (Ni0) и катодному восстановлению ионов никеля (Ni2+), т.е. переносу никеля с анода на катод. При этом количество электролита в растворе остается неизменным.
