Гальванические элементы
Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то во внешней цепи возникнет направленное перемещение электронов – электрический ток. При этом энергия, химической окислительно-восстановительной реакции превращается в электрическую энергию. Устройства, в которых происходит такое превращение, называются химическими источниками электрической энергии, или гальваническими элементами.
Всякий гальванический элемент состоит из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом обычно через пористую перегородку. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом; электрод, на котором осуществляется восстановление – катодом.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция
Zn + 2AgNО3 = Zn(NО3)2 + 2Ag,
изображается следующим образом:
Zn | Zn(NО3)2 || AgNО 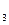 | Ag.
| Ag.
Эта же схема может быть изображена в ионной форме:
Zn | Zn2+ || Ag+ | Ag.
В данном случае металлические электроды непосредственно участвуют в происходящей реакции. На аноде цинк окисляется Zn = Zn2+ + 2 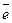 и в форме ионов переходит в раствор, а на катоде серебро восстанавливается Ag+ +
и в форме ионов переходит в раствор, а на катоде серебро восстанавливается Ag+ + 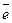 =Ag
=Ag
и в виде металла осаждается на электроде. Складывая уравнения электродных процессов (с учетом числа принимаемых и отдаваемых электронов), получаем суммарное уравнение реакции: Zn+2Ag+ = Zn2+ + 2Ag.
Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой (ЭДС) элемента. Если реакция осуществляется в стандартных условиях, т. е. если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом ЭДС называется стандартной электродвижущей силой данного элемента.
ЭДС гальванического элемента может быть представлена как разность двух электродных потенциалов Е, каждый из которых отвечает полуреакции, протекающей на одном из электродов. Так, для рассмотренного выше серебряно-цинкового элемента ЭДС выражается разностью:
ЭДС = ЕAg – ЕZn .
Здесь ЕAg и ЕZn – потенциалы, отвечающие электродным процессам, происходящим соответственно на серебряном и цинковом электродах.
При вычислении электродвижущей силы меньший (в алгебраическом смысле) электродный потенциал вычитается из большего.
Пример 1. Стандартный электродный потенциал никеля больше, чем у кобальта. Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 г-ион/л, а кобальта – 0,1 г-ион/л?
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е = Е0 + 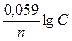 .
.
Е° для никеля и кобальта соответственно равны – 0,25 и – 0,277В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
ЕNi2+/Ni = – 0,25 + 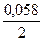 lg 10-3 = – 0,337 В,
lg 10-3 = – 0,337 В,
ЕCo2+/Co = – 0,277 + 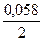 lg 10-1 = – 0,306 В.
lg 10-1 = – 0,306 В.
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен –2,41 В. Вычислите концентрацию ионов магния в г-ион/л.
Решение.Подобные задачи также решаются на основании уравнения Нернста:
–2,41 = –2,37 + 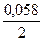 lg C,
lg C,
–0,04 = 0,029 lg С,
lgC = – 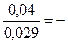 1,3793=
1,3793= 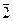 ,6207,
,6207,
CMg2+ = 4,17 · 10-2 г-ион/л.
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 г-ион/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
(–) Mg | Mg2+ || Zn2+ | Zn(+)
Вертикальная черта обозначает поверхность раздела между металлом и раствором, а две черточки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (–2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg –2 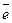 = Mg2+. (1)
= Mg2+. (1)
Цинк, потенциал которого –0,763В, – катод, т. е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2 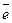 = Zn (2)
= Zn (2)
Уравнение окислительно-восстановительной реакции, которая лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg + Zn2+ = Mg2+ + Zn
Для определения электродвижущей силы – ЭДС, гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 г-ион/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
ЭДС = 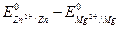 = – 0,763 – (– 2,37) = 1,607 В.
= – 0,763 – (– 2,37) = 1,607 В.
Коррозия металлов.
