Гальванические элементы
И ИХ ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ
Гальванический элемент – это устройство, в котором энергия химической реакции превращается в электрическую. Он состоит из двух полуэлементов, а именно из двух растворов, соприкасающихся друг с другом, в которые погружены металлические электроды, соединенные внешним проводником.
В гальваническом элементе сами по себе равновесные электроды образуют неравновесную систему, дающую электрический ток. Если сила тока в системе мала и система практически находится в состоянии равновесия, элемент этот работает обратимо.
Максимальная разность потенциалов, достигаемая при обратимой работе гальванического элемента, называется его электродвижущей силой.
В качестве обратимого гальванического элемента удобно рассмотреть элемент Якоби – Даниеля, который состоит из медного и цинкового электродов, погруженных соответственно в растворы ZnSO4 и CuSO4 . Схематично этот элемент изображается следующим образом (рис. 5):
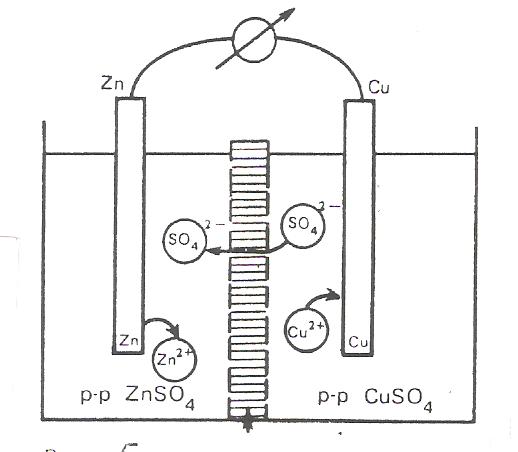
Рис. 5. Гальваническийи элемент
Якоби-Даниэля
Zn|ZnSO4 ||CuSO4 ||Cu
Разомкнутый элемент находится в заторможенном неравновесном состоянии и может пребывать в этом состоянии как угодно долго.
При замыкании электродов металлическим проводником наблюдается иная картина: электроны по нему переходят от цинкового электрода к медному. Этот процесс сопровождается переходом ионов цинка с электрода в раствор и осаждением ионов меди из раствора на электрод.
Оба эти процесса являются результатом окислительно-восстановительной реакции.
На цинковом электроде протекает реакция окисления:
Zn(т) ↔ Zn²+(p) + 2ē ; ∆ G° = - 146 кДж
На медном – полуреакция восстановления:
Cu²+ (p) + 2ē ↔ Cu(т) ; ∆G° = - 66 кДж
Следовательно, электрический ток обусловлен суммарной окислительно-восстановительной реакцией:
Cu²+ (p) + Zn(т) ↔ Cu(т) + Zn²+ (p) ; ∆ G° = - 212 кДж
Раствор в приэлектродном пространстве цинкового электрода обогащается ионами цинка, а медного электрода обедняется ионами меди. Вследствие этого сульфат – ионы перемещаются через пористую перегородку из раствора сульфата меди в раствор сульфата цинка, увеличивая его концентрацию. Катионы цинка диффундируют в обратном направлении, замещая перешедшие на медный электрод катионы меди. В результате этого раствор сульфата меди постепенно превращается в сульфат цинка.
Гальванический элемент будет работать до тех пор, пока весь цинковый электрод не раствориться. После этого электрический ток прекратиться.
При работе гальванического элемента происходит одновременный перенос электричества по двум цепям: внешней (поток электронов по проводнику) и внутренней (поток ионов в жидкой фазе элемента).
Цинк для внешней цепи играет роль катода, так как посылает во внешнюю цепь поток электронов, а для внутренней цепи – анода, так как посылает во внутреннюю цепь положительно заряженные катионы.
Медь для внешней цепи играет роль анода – акцептор электронов, а для внутренней цепи роль катода – донор электронов.
Общее выражение для ЭДС гальванического элемента.
Обозначим электрохимическую реакцию следующим образом:
аА+ вВ ↔ сС + дД
Для реакции, протекающей при постоянных давлении и температуре, убыль энергии Гиббса можно оценить с помощью уравнения изотермы химической реакции:
∆G = - RT ln Ka + RT ln (aсC · adD /aaA · abB)
В соответствии со вторым началом термодинамики максимальная работа равна убыли энергии Гиббса
W max = - ∆G.
Электрическая работа в изобарно – изотермических условиях равна
W max = zFE , где Е= ЭДС
Следовательно:
zFE = RT ln Ka – RT ln(aсC · adD /aaA · abB)
Разделив обе части уравнения на величину zF получим
RT RT
E = ln Ka – ln(aсC · adD /aaA · abB)
zF zF
Выражение RT/zF ln Ka при Т = const, является величиной постоянной, определяемой свойствами электродов. Эту величину обозначают через Е° и называют стандартной ЭДС.
В конечном итоге следует общее выражение для ЭДС гальванического элемента.
RT
E = Е° - ln(aсC · adD /aaA · abB)
zF
Конкретно для реакции Zn(т) + Cu²+(т) ↔ Zn²+(p) + Cu (т), протекающей в гальваническом элементе Якоби - Даниеля, выражение для ЭДС можно записать следующим образом:
RT а (Zn²+)
Е = Е°– ln
zF а (Cu²+)
Где активность твердого вещества (металла) при данной температуре постоянна и равна единице.
