Химические свойства галогеналканов
ЛЕКЦИЯ 18
ГАЛОГЕНПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ ГАЛОГЕНЗАМЕЩЕННЫЕ АЛКАНОВ
17.1. Номенклатура и изомерия
17.2. Способы образования связи углерод-галоген
17.3. Химические свойства галогеналканов
17.3.1. Полярность и поляризуемость связи углерод-галоген
17.3.2. Реакции нуклеофильного замещения: кинетика, стереохимия, энергетический профиль; влияние природы субстрата, реагента и растворителя на скорость реакций SN1 и SN2
17.3.3. Реакции нуклеофильного замещения при получении спиртов, простых и сложных эфиров, аминов, тиолов, нитрилов и др. из галогензамещенных алканов
Номенклатура и изомерия
Галогенуглеводородами называются производные углеводородов, в которых один или несколько атомов водорода заменены на атомы галогена.
В зависимости от природы галогена различают:
фторо-, хлоро-, бромо- и иодопроизводные, содержащие атомы различных галогенов;
смешанные производные, содержащие атомы различных галогенов.
Номенклатура.По заместительной номенклатуре:
1) указывается номер атома (углерода), к которому крепится галоген;
2) называется сам галоген (если галогенов несколько, то их названия указываются в алфавитном порядке);
3) называется сам углеводород соответственно количеству атомов (углерода).
Изомерия.Изомерия галогенводородов определяется изомерией углеродного скелета и положением атома галогена.
Классификация. Галогеналканы подразделяются на первичные, вторичные и третичные в зависимости от того, с каким атомом водорода связан галогеналкан:
CH3CH2F - этилфторид (первичный)
CH3CH2CHBrCH3 - 2-бромбутан (втор-бутилбромид)
(CH3)3CCl - 2-метил-2-хлорпропан (трет-бутилхлорид)
Способы образования связи углерод-галоген
Галогенводороды также подразделяются по способу гибридизации атома углерода, с которым связан атом галогена, поскольку это существенно влияет на их реакционную способность:
- в галогеналканах атом галогена связан с sp3–гибридизованнным атомом углерода;
- в галогенаренах (ArHal) и в галогеналкенах типа RCH=CHHal c sp2-гибридизованным атомом углерода;
- выделяются также галогенпроизводные аллильного типа RCH=CH2Hal и бензильного типа ArCH2Hal:
sp3 sp3 sp2
CH3CH2Br R-CH=CH-CH2-Hal R-CH=CH-Hal
Химические свойства галогеналканов
Галогенпроизводные углеводородов - весьма реакционноспособные соединения, широко применяются в разнообразных органических синтезах.
Наиболее характерные реакции этого класса:
- реакции замещения (S);
- отщепления (E).
В реакциях нуклеофильного замещения реагенты предоставляют свои электроны углероду, с которым связан галоген (проявляют нуклеофильные свойства), заместившийся Hal уходит в виде аниона:
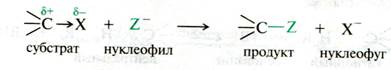
Природа галогена обусловливает полярность, поляризуемость и прочность связи углерод-галоген, что и определяет реакционную способность конкретного галогеналкана.
Прочность связи. Ниже приведены энергии гемолитического разрыва связей sp3-X:
CH3-H 435
CH3-CH3 368
CH3-F 456
CH3-Cl 351
CH3-Br 293
CH3-I 234 кДж/моль
1. Наиболее прочной является связь C-F, для ее разрыва требуется больше энергии, чем С-Н или С-С.
2. Связь углерод-фтор наиболее полярна. Ковалентный радиус атома фтора значительно меньше, чем хлора, брома и йода.
3. Прочность связи С-Х закономерно уменьшается при переходе от фтора хлора, брома к йоду.
Полярность и поляризуемость связи. Для реакционной способности важное значение имеет не только полярность, но и поляризуемость связи.
!!! Поляризуемость связи - легкость смещения электронного облака связи к галогену под внешним воздействием).
1. Среди рассматриваемых связей, наиболее поляризуемой является связь углерод-йод.
2. Возрастание реакционной способности галогенуглеводородов в реакциях нуклеофильного замещения:
RI ˃ RBr ˃ RCl ˃ RF
3. В целом, наличиев молекуле электроотрицательного атома галогена приводит к перераспределению электронной плотности, в результате чего возникают два реакционных центра:
- электрофильный центр - атом углерода, связанный с галогеном;
- СН-кислотный центр - полярная связь С-Н у атома углерода в β-положении к галогену.
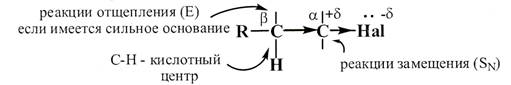
Рис. 17.1. Реакционные центры в молекуле галогенводородов
1. Электрофильный центр (α-атом углерода) возникает вследствие поляризации связи C-Hal и может подвергаться атаке нуклеофилом. В результате такого взаимодействия происходит замещение галогена на нуклеофил, т.е. осуществляется реакция нуклеофильного замещения.
2. Если в реакционной среде имеется сильное основание, то в этом случае реакция протекает с участием СН-кислотного центра. Результатом такой реакции является элиминирование (отщепление) атомов водорода и галогена от соседних углеродов.
17.3.2. Реакции нуклеофильного замещения: кинетика, стереохимия, энергетический профиль; влияние природы субстрата, реагента и растворителя на скорость реакций SN1 и SN2
17.3.2.1. Реакции нуклеофильного замещения у sp3–гибридизованнного атома углерода
!!!Механизм реакции бимолекулярного нуклеофильного замещения:
1. Атака нуклеофилом электофильного атома углерода в галогенсодержащем субстрате приводит к гетеролитическому разрыву связи углерод-галоген и замещению галогена.
2. Галоген является в данном случае уходящей группой (нуклеофугом).
3. Возникающая в продукте ковалентная связь образуется за счет пары электронов, которую приносит нуклеофил.
4. К уходящей группе переходит пара электронов бывшей связи галоген-углерод субстрата:
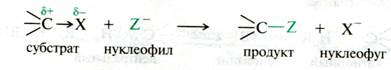
Рис. 18.2. Схема реакции нуклеофильного замещения sp3–гибридизованнного атома углерода в галогензамещенных алканах
Реакция нуклеофильного замещения осуществляется в том случае, если уходящаягруппа стабильнее вступающего нуклеофила.
В ряду галогенид-ионов:
- наиболее стабилен иодид-ион;
- затем бромид-ион и хлорид-ион;
- наименее стабилен фторид-ион.
Таким образом, с учетом прочности и поляризуемости связей углерод-галоген и стабильности уходящего аниона галогеналканы располагаются в следующий ряд по уменьшению реакционной способности в реакциях нуклеофильного замащеения:
C-I ˃ C-Br ˃ C-Cl ˃˃ C-F
Реакционная способность в реакциях нуклеофильного замещения уменьшается
----------------------------------------------------------------------------------------------------˃
