Направление присоединения галогеноводородов к алкенам
v Правило Марковникова. Взаимодействие алкенов с галогеноводородами зависит от строения ненасыщенного углеводорода и силы кислоты. Реакционная способность уменьшается в ряду: HI > HBr > HCl > HF.
В случае несимметричных алкенов присоединение галогеноводородов протекает согласно правилу Марковникова[11] (1869 г.).
Ø Правило Марковникова – в реакциях присоединения к алкенам атом водорода присоединяется к наиболее гидрированному атому углерода двойной связи.
Правило Марковникова может быть объяснено поляризацией алкена под действием электроно-донорных эффектов заместителей (+I-эффект и эффект сверхсопряжения).
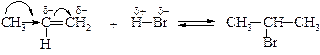
Ниже приводится двухстадийный механизм присоединения бромоводорода к алкенам также объясняющий правило Марковникова. Из двух промежуточных карбкатионов более устойчивым является вторичный, т.к. он стабилизирован двумя алкильными группами, обладающими +I-эффектом.
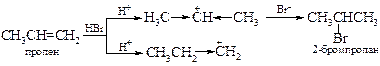
Реакция преимущественно протекает через более устойчивое переходное состояние (см. Рис. 8.4), для которого, соответственно, энергия активации (Еа2) будет меньшей.
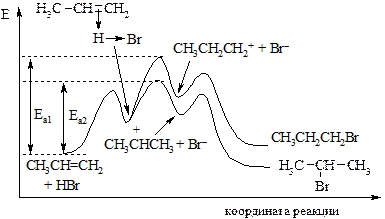
Рис. 8.4. Энергетическая диаграмма реакции гидрохлорирования пропена
Ø Современная трактовка правила Марковникова – электрофильное присоединение к двойной углерод-углеродной связи протекает через стадию образования наиболее устойчивого карбкатиона.
| Например: | 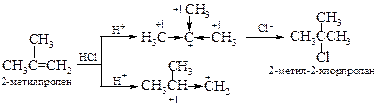 |
· Устойчивость карбкатионов. Карбкатион представляет собой плоскую структуру с sp2-гибридным электронодефицитным атомом углерода. Вакантная р-орбиталь перпендикулярна плоскости молекулы. Алкильные заместители, обладающие положительным индуктивным эффектом, компенсируют положительный заряд на атоме углерода и тем самым увеличивают устойчивость карбкатиона. Наиболее устойчивы третичные алкильные карбкатионы, наименьшая стабильность у метильного карбкатиона.
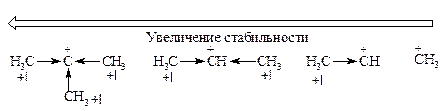
Наряду с индуктивным эффектом для объяснения стабилизации карбкатиона используют эффект гиперконъюгации – сопряжение электронных облаков s-связей С-Н с вакантной орбиталью.
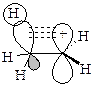
стабилизация карбкатиона посредством гиперконъюгации
Еще большей устойчивостью, чем алкильные третичные карбкатионы, обладают карбкатионы, стабилизированные находящимися рядом p-электронными системами, например аллильный или бензильный карбкатион. В результате сопряжения положительный заряд в таких карбкатионах делокализуется по системе углеродных атомов.
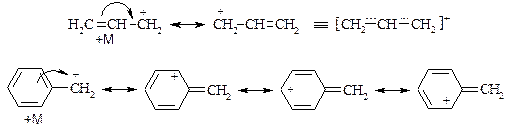
Легкость образования карбкатионов изменяется в том же порядке, что и их устойчивость: третичный > вторичный > первичный, что позволяет расположить алкены по реакционной способности в отношению к реакциям присоединения кислых реагентов типа HZ в следующем порядке: (CH3)2C=CH2 > CH3CH=CHCH3 > CH3CH2CH=CH2 > > CH3CH=CH2 > CH2=CH2 > CH2=CHCl.
· Присоединение к алкенам, содержащим электроноакцепторную группу. Современное толкование правила Марковникова объясняет структуру продукта присоединения хлороводорода по двойной углерод-углеродной связи, рядом с которой находится электроноакцепторная группа. Классическое правило в данном случае не работает.
Например, в приведенной ниже реакции присоединение протекает против классического правила Марковникова. Вторичный карбкатион (1) менее стабилен по сравнению с первичным карбкатионом (2), т.к. в первом случае действуют сильные –I и –М-эффекты карбоксильной группы, которые дестабилизируют карбкатион (1), и реакция идет через образование наиболее стабильного карбкатиона (2).
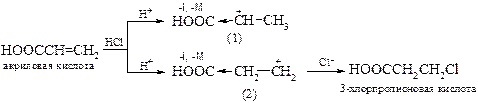
Аналогично происходит и присоединение хлороводорода к 3,3,3-трифторпропену.
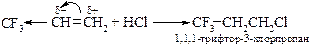
§ Поскольку реакции электрофильного присоединения идут через стадию образования карбкатионов, то в некоторых случаях возможны перегруппировки, которые характерны для этих частиц. Обычно происходит перегруппировка в более устойчивый карбкатион.

§ Если при присоединении галогеноводорода к алкену возникает хиральный центр, то происходит образование рацемической смеси в эквимольном соотношении.
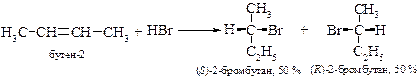
Такой результат объясняется образованием карбкатиона, в котором прохиральный атом углерода находится в sp2-гибридном состоянии, а сам интермедиат имеет плоскую структуру. Поэтому атака карбкатиона анионом равновероятна с обеих сторон.
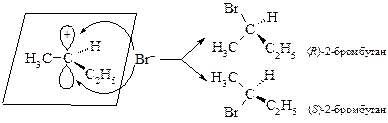
§ Современные исследования показывают, что во многих случаях присоединение протекает не через карбкатион, а образуется интермедиат, несущий частичный положительный заряд на наиболее замещенном атоме углерода, где он максимально компенсируется. А сама реакция протекает как тримолекулярное анти-присоединение (механизм АЕ3).
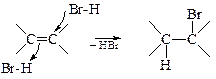
v Перекисный эффект Караша. Следует отметить, что правило Марковникова соблюдается только при ионном присоединении галогеноводородов и полном отсутствии кислорода и других окислителей в исходных реагентах и растворителе. При радикальном присоединении бромоводорода наблюдается обратное по направленности присоединение. Первым эту реакцию изучил М. Караш[12], который отметил ключевую роль в изменении направления реакции следовых количеств пероксидов, присутствующих во многих растворителях и исходных алкенах. Отсюда и пошло название – перекисный эффект Караша.
Причина изменения механизма реакции заключается в действии пероксидов (на схеме для простоты показан пероксид водорода) на бромоводород с образованием свободных радикалов брома. Далее процесс протекает через более устойчивый вторичный алкильный радикал. В ходе реакции постоянно генерируются свободные радикалы, поэтому для инициирования реакции по механизму АR достаточно следов пероксидов.
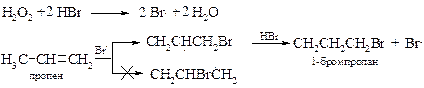
При низких температурах (-80 °С) радикальная реакция бромоводорода с алкенами протекает через циклический радикал и идет как анти-присоединение.
Перекисныйэффект присущ только для бромоводорода. Ни хлороводород, ни иодоводород не способны к такому присоединению. В случае HCl процесс не реализуется из-за прочности связи хлор–водород, в которой электронная плотность сильно смещена к атому хлора. Для этого соединения протекает гетеролитическое, а не гомолитическое расщепление. В случае HI свободный радикал иода легко генерируется, но процесс не протекает из-за высокой энергии активации присоединения атомарного иода к двойной связи.
