Блок 1. Энергетика химических процессов.
КОНТРОЛЬНАЯ РАБОТА № 2.
По разделу «Энергетика химических процессов. Химическое равновесие».
Варианты заданий выбираются по двум последним цифрам в зачетной книжке (студенческом билете).
Таблица 1. Варианты заданий (блок 1, блок 2, блок 3).
| № варианта | № заданий |
| 1, 11, 21 | 1, 11 |
| 2, 12, 22 | 2, 12 |
| 3, 13, 23 | 3, 13 |
| 4, 14, 24 | 4, 14 |
| 5, 15, 25 | 5, 15 |
| 6, 16, 26 | 6, 16 |
| 7, 17, 27 | 7, 17 |
| 8, 18, 28 | 8, 18 |
| 9, 19, 29 | 9, 19 |
| 10, 20, 30 | 10, 20 |
Блок 1. Энергетика химических процессов.
1. Можно ли при н.у. восстановить РbO2(к) цинком по реакции: PbO2(к) + 2Zn(к) = Pb(к) + 2ZnO(к).
2. Подтвердите расчетом, что реакция горения ацетилена в н.у. идет по уравнению: С2Н2(г) + 5/2О2(г) = Н2О(ж) + 2СО2(г) и объясните уменьшение энтропии в результате этой реакции.
3. Возможно ли восстановление Fе3О4 оксидом углерода при н.у. по реакции: Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г).
4. Прямая или обратная реакция 2NО(г) + О2(г) =2NО2(г) будет протекать при стандартных условиях. Ответ мотивируйте.
5. Может ли реакция NН3(г) + НCl(г) = NН4Сl(к) при 30°С идти самопроизвольно в прямом направлении. Ответ мотивируйте.
6. Возможна ли реакция 4NН3(г) + 5О2(г) = 4NО(г) + 6Н2О(г) при стандартных условиях. Ответ мотивируйте, используя табличные значения 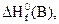 So соответствующих веществ.
So соответствующих веществ.
7. Будет ли протекать реакция СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж) при 27 °С?
8. При какой из температур 500 К или 2000 К будет протекать реакция: Fе2О3(к) + 3Н2(г) = 2Fе(к) + 3Н2О(г)?
9. При какой из температур 1000 К или 3000 К возможна реакция восстановления диоксида титана углеродом: ТiО2(к) + 2С(к) = Тi(к) + 2СО(г).?
10. Можно ли получить метан СН4 при 40о С по реакции: СО(г) + 3Н2(г) = СН4(г) + Н2О(г).
11. Какая из двух реакций а) 2Fе(к) + Аl2О3(к) = 2Аl(к) + Fе2О3(к); или б) СО(г) + Fе3О4(к) = 3FеО(к) + СО(г) протекает самопроизвольно при н.у. Ответ мотивируйте.
12. Какая из реакций будет протекать при н.у. Ответ мотивируйте:
а) N2(г) + 1/2О2(г) = N2О(г); или б) 4НСl (г) + О2(г) = 2Сl2(г) + 2Н2О(ж).
13. Восстановление магнетита (Fe3O4) до оксида железа (II), можно осуществить двумя способами:
1) Fе3О4 (к) + СО(г) = 3FеО (к) + СО2(г)
2) Fе3О4 (к) + Н2 (г) = 3FеО (к) + Н2О(ж).
Какой из этих способов энергетически более выгоден?
14. Возможно ли в стандартных условиях взаимодействие гашеной извести с углекислым газом: Са(ОН)2 (к) + СО2(г) = СаСО3(к) + Н2О(ж)?
15. Взаимодействие какого оксида (Na2O или СuО) с водой наиболее вероятно в стандартных условиях: Na2O (к) + Н2О(ж) = 2NaOH(к) или CuO (к) + Н2О(ж) = Сu(ОН)2(к)?
16. Пойдет ли при 1200 ° С реакция разложения карбоната кальция: СаСО3(к) = СаО(к) + СО2(г)?
17. Вычислите ΔН0, ΔS0, ΔG0 реакции, протекающей по уравнению: Fе2О3(к) + 3Н2(г) = 2Fе(к) + 3Н2О(г). Возможна ли эта реакция восстановления Fе2О3(к) при температуре 500 К и 2000 К?
18. Вычислите ΔН0, ΔS0, ΔG0 реакции, протекающей по уравнению: TiO2(к) + 2С(графит) = Тi(к) + 2СО(г). Возможна ли реакция восстановления ТiO2(к) углеродом при температурах 800 °С и 2500 °С?
19. Качественно оцените и объясните знак ΔS0 реакций:
l) 2SO2(г) + O2(г) = 2SO3(г),
2) СО(г) + 3Н2(г) = СH4(г) + Н2О(ж),
3) СО2(г) + 2Mg(к) = 2MgO(к) + С(графит).
Подтвердите свой вывод расчетами.
20. По каким из ниже перечисленных реакций можно получить бензол?
1) 3С2Н4 (г) = С6Н6 (г) + 3Н2 (г),
2) 3С2Н2(г) = С6Н6(г),
3) 6СО2(г)+15Н2(г) = С6Н6 (г) + 12Н2О(г).
Таблица 2. Стандартные значения термодинамических величин
