III. Энергетика химических процессов
Типовые задачи и их решение
1. Рассчитать тепловой эффект реакции образования «водяного газа» (СО + Н2): С(графит) + Н2О(п) = СО(г) + Н2(г). Записать данное термохимическое уравнение. Сделать вывод: реакция экзо- или эндотермическая? Стандартные энтальпии образования веществ приведены из таблицы 2, стр. 34:
DfНо (298) СО(г) = –110,5 кДж/моль; DfНо (298) Н2О(п) = –241,83 кДж/моль;
DfНо (298) для простых веществ (Н2, С) равны нулю.
Решение.Согласно следствию из закона Гесса изменение энтальпии химической реакции (тепловой эффект) будет равно:
DНо (298) = DfНо (298) СО(г) - DfНо (298) H2O(п) = –110,5 – (–241,8) = 131,3 кДж.
Реакция – эндотермическая, происходит поглощение тепла, т.к. DНо (298) > 0.
Термохимическое уравнение будет иметь вид:
C(графит) + H2O(п) = CO(г) + H2(г); DНо (298) = 131,3 кДж.
2.Вычислить изменение энтропии реакции, рассмотренной в задаче 1.
Решение.C(графит) + H2O(п) = CO(г) + Н2(г)
В таблице 3 (стр. 35) термодинамических величин находим абсолютные стандартные энтропии веществ:
Sо (298) С(графит) = 5,7 Дж/моль К; Sо (298) H2O(п) = 188,7 Дж/моль К;
Sо (298) CO(г) = 197,9 Дж/моль К; Sо (298) H2(г) = 130,6 Дж/моль К.
Используем следствие из закона Гесса:
DSо (298) = [Sо (298) CO(г) + Sо (298) H2(г) ] - [Sо (298) C(графит) + Sо (298) H2O(п)].
Подставляем значения и вычисляем:
DSо (298) = (197,9 + 130,6) - (5,7 + 188,7) = 328,5 - 194,4 = 134,1 Дж/К.
Энтропия реакции увеличивается.
3. Вычислить изменение изобарно-изотермического потенциала в реакции образования «водяного газа» (см. задачу 1) при температурах: 25, 1000, 1100 оС. Сделать вывод о возможности протекания процесса.
Решение.Возможность самопроизвольного протекания реакции определяется значением изменения энергии Гиббса. Используем данные, полученные в ранее решенных задачах:
- изменение энтальпии: DНо (298) = 131,3 кДж (см.задачу 1);
- изменение энтропии: DSо (298) = 134,1 Дж/К (см.задачу 2).
Определим значение DGо при 25 оС (298 К), используя:
1) уравнение Гиббса:
DGо (298) = DHо (298) – T ∙ DSо (298).
Подставим значения и вычислим:
DGо (298) = 131,3 – (298 ∙ 134,1∙10–3) = 131,3 – 39,96 = 91,3 кДж.
Здесь введен множитель 10–3 по той причине, что DHо (298) выражен в [кДж], а DSо (298) имеет размерность [Дж/К].
Вывод: реакция слева направо при 25оС самопроизвольно протекать не может, поскольку DGо(298)> О.
2) следствие из закона Гесса:
DGо (298) = [DfGо (298) CO(г) + DfGо (298) H2(г) ] – [DfGо (298) H2O(п) +
+ DfGо (298) C(графит) ]
Подставим значения DfGо (298) веществ из таблицы 3 (стр. 35) и вычислим:
DGо (298) = –137,1 – (–228,6) = 91,5 кДж.
Для простых веществ: DfGо (298) H2(г) и DfGо (298) C(графит) равны нулю.
На основании расчетов делаем вывод: реакция слева направо при 25оС самопроизвольно протекать не может, поскольку DGо(298)> О.
При 1000 оС (1273 К):
DGо (1273) = 131,3 – (1273 ∙ 134,1∙10–3) = 131,3 – 170,7 = –39,4 кДж.
Поскольку при 1000 оС: DGо < 0, то реакция становится возможной.
При 1100 оС (1373 К):
DGо (1373) = 131,3 – (1373 ∙ 134,1∙10–3) = 131,3 – 184,1 = –52,8 кДж.
Меньшее значение DGо (1373) по сравнению с DGо (1273) свидетельствует о смещении равновесия вправо, и эндотермическая реакция становится устойчивой, т. е. протекает самопроизвольно.
Таким образом, химическая термодинамика позволяет установить принципиальную возможность протекания химической реакции и решить вопрос об условиях ее равновесия.
Таблица 2
Стандартные энтальпии образования веществ
| Вещество, cостояние | DfНо (298); кДж/моль | Вещество, Состояние | DfНо (298) кДж/моль |
| NО (г) | 90,2 | Са3(РО4)2 (к) | –4137,6 |
| NО2 (г) | 33,0 | С2Н4 (г) | 52,3 |
| СаО (т) | –635,5 | Н2О (п) | –241,8 |
| Р2О5 (к) | –2984,0 | С2Н5ОН (г) | –235,3 |
| Са(ОН)2 (т) | –986,2 | Н2О (ж) | –285,8 |
| Fе2О3(к) | –822,2 | СО (г) | –110,5 |
| СО2 (г) | –393,5 | СН4 (г) | –74,9 |
| МgСО3 (к) | –1113,0 | МgО (к) | –601,8 |
| СаСО3 (к) | –1206,9 | NН3 (г) | –46,2 |
| NiCl2 (к) | –304,2 | НСl (г) | –91,8 |
| PdO (т) | –115,5 | NН4Сl (к) | –314,2 |
| (NH2)2CO(т) | –319,2 | NH4NO3 (т) | –365,4 |
| С2Н2 (г) | 226,8 |
Таблица 3
Абсолютные стандартные энтропии веществ
| Вещество, состояние | Sо (298); Дж/моль∙K | Вещество, coстояние | Sо (298); Дж/моль∙K |
| N2 (г) | 191,5 | H2 (г) | 130,5 |
| NH3 (г) | 192,6 | СO2 (г) | 213,7 |
| СО (г) | 197,6 | Н2О (ж) | 70,1 |
| H2О (п) | 188,7 | NН4Сl (к) | 95,8 |
| НСl (г) | 186,8 | NО (г) | 210,6 |
| О2 (г) | 205,0 | NO2 (г) | 240,2 |
| Ni (к) | 29,9 | NiCl2 (к) | 98,1 |
| PdO (т) | 38,9 | Pd (т) | 37,7 |
| (NH2)2CO(т) | 173,8 | NH4NO3 (т) | 151,0 |
| СН4 (г) | 186,2 | С2Н2 (г) | 200,8 |
| С (графит) | 5,7 | Fe2O3 (к) | 87,5 |
| Fe (к) | 27,2 | СН3ОН (г) | 126,8 |
Таблица 4
Стандартные энергии Гиббса образования веществ
| Вещество, состояние | DfGо (298); кДж/моль | Вещество, cостояние | DfGо (298); кДж/моль |
| NО (г) | 86,6 | ZnO (к) | –320,7 |
| NО2 (г) | 51,5 | ВеСО3 (к) | –944,7 |
| СаО (к) | –604,2 | Fе(ОН)3 (к) | –699,6 |
| Fе(ОН)2 (к) | –479,7 | Сr2О3 (к) | –1059,0 |
| Аl2О3 (к) | –1582,0 | Н2О (ж) | –237,2 |
| ВеО (к) | –582,0 | СО (г) | –137,1 |
| СО2 (г) | –394,4 | CuO (к) | –129,4 |
| МgСО3 (к) | –1029,3 | МgО (к) | –569,6 |
| СаСО3 (к) | –1128,8 | HCl (г) | –94,8 |
| ZnCl2 (к) | –369,4 | WO3 (к) | –763,9 |
| СаС2 (т) | –67,8 | С2Н2 (г) | 208,4 |
| Са(ОН)2 (т) | –896,8 | Н2О (п) | –228,6 |
Контрольные задачи
1. Пользуясь необходимыми термодинамическими величинами (таблица 2, стр. 34), определить: экзо- или эндотермической является данная реакция в стандартных условиях: 2NО(г) + О2(г) = 2NO2(г). Записать данное термохимическое уравнение.
2. Рассчитать тепловой эффект химической реакции: 3СаО(к) + Р2О5 (к) = = Са3(РО4)2(к), пользуясь необходимыми термодинамическими величинами (табл. 2, стр. 34). Записать данное термохимическое уравнение.
3. Вычислить тепловой эффект реакции гидратации этилена с образованием этилового спирта (в стандартных условиях): С2Н4(г) + Н2О(п) =
= С2Н5ОН(г), пользуясь необходимыми термодинамическими величинами (табл. 2, стр. 34). Записать данное термохимическое уравнение.
4. Пользуясь термодинамическими величинами (табл. 2, стр. 34), рассчитать: сколько тепла выделится при гашении водой 500 кг негашеной извести СаО, содержащей 20% примесей (условия – стандартные)?
5. При соединении 20 граммов алюминия с кислородом в стандартных условиях выделилось 609,6 кДж. Определить стандартную энтальпию образования оксида алюминия DfНо (298). Записать данное термохимическое уравнение.
6.Пользуясь стандартными энтальпиями образования веществ (табл. 2, стр. 34), вычислить тепловой эффект реакции: Fе2О3(т) + 3СО(г) = 2Fе(т) +
+ 3СО2(г). Записать данное термохимическое уравнение.
7. Пользуясь стандартными энтальпиями образования веществ (табл. 2, стр. 34), определить стандартные энтальпии сгорания веществ: а) СН4(г),
б) С2Н5ОН(г). При сгорании какого вещества: а) СН4(г) или б) С2Н5ОН(г) выделится больше энергии? Учесть, что при полном сгорании веществ образуются СО2(г) и Н2О(ж).
8. Реакция горения аммиака выражается термохимическим уравнением: 4NН3(г) + 3О2(г) = 2N2(г) + 6Н2О(ж), DНо (298) = –1530,28 кДж. Вычислить стандартную энтальпию образования NН3(г), если DfНо (298) H2O(ж) = –285,8 кДж.
9. Определить, каким способом легче получить медь в стандартных условиях: а) СuO(т) + C(т) = Cu(т) + CO(г); б) СuO(т) + H2(г) = Cu(т) + H2O(ж)? Использовать для расчетов термодинамические величины из таблицы 4, стр. 35.
10. Восстановление Fе2О3 водородом протекает по уравнению: Fе2О3(к) + + 3Н2(г) = 2Fе(к) + 3Н2О(п), DНо (298) = +96,6 кДж. Возможна ли эта реакция в стандартных условиях? Ответ подтвердить, рассчитав DSо (298), используя данные табл. 3, стр. 35 и DGо (298) реакции по уравнению Гиббса.
11. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция: N2(г) + 3Н2(г) = 2NН3(г), DНо (298) = –92,4 кДж? Ответ подтвердить необходимыми расчетами DSо (298), используя данные табл. 3, стр. 35 и DGо (298) реакции по уравнению Гиббса.
12. Будет ли протекать реакция: ZnО(к) + СО(г) = Zn(к) + СО2(г) при стандартных условиях? Ответ дать на основаниии расчета DGо (298) реакции, используя термодинамические величины из таблицы 4, стр. 35.
13. Какая степень окисления: +2 или +3 более характерна для железа? Сделать вывод, вычислив DGо (298) реакции, используя термодинамические величины из таблицы 4 (стр. 35): 4Fе(ОН)2(к) + О2(г) + 2Н2О(ж) = 4Fе(ОН)3(к).
14. Определить DНо (298) и DGо (298) реакций:
а) МgСО3(к) = МgО(к) + СО2(г); б) СаСО3(к) = СаО(к) + СО2(г), используя термодинамические величины из таблиц 2 (стр. 34) и 4 (стр. 35). Сделать вывод: какой из карбонатов обладает большей термической устойчивостью?
15. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция: Н2(г) + СО2(г) = СО(г) + Н2О(ж), тепловой эффект которой равен DНо (298) = –2,85 кДж? Ответ подтвердить расчетами DSо (298), используя термодинамические величины из таблицы 3 (стр. 35), и DGо (298) реакции, используя уравнение Гиббса.
16. Будет ли протекать в стандартных условиях реакция: 2NО(г) +
+ О2(г) =2NО2(г)? Ответ мотивировать, вычислив DGо (298) данной реакции, используя уравнение Гиббса. Для расчета DНо (298) и DSо (298) реакции использовать термодинамические величины из таблиц 2 (стр. 34) и 3 (стр. 35).
17. Исходя из значений стандартных энтальпий образования (табл. 2, стр. 34) и абсолютных стандартных энтропий (табл. 3, стр. 35) соответствующих веществ, вычислить DGо (298), используя уравнение Гиббса, реакции, протекающей по уравнению: NН3(г) + НСl(г) = NН4Сl(к). Будет ли данная реакция протекать самопроизвольна при стандартных условиях?
18. Определить по уравнению Гиббса DGо (298) реакции: 4NН3(г) +
+ 5О2(г) = 4NО(г) + 6Н2О(п). Вычисления сделать, используя стандартные энтальпии образования DfНо (298) в табл. 2 (стр. 34) и абсолютные стандартные энтропии Sо (298) в табл. 3 (стр. 35) соответствующих веществ. Возможна ли эта реакция в стандартных условиях?
19. Какой из карбонатов: ВеСО3(к) или СаСО3(к), можно получить по реакции взаимодействия соответствующих основных оксидов с диоксидом углерода (II) – СО2? Сделать вывод, вычислив DGо (298) реакций, используя термодинамические величины из таблицы 4 (стр. 35).
20. Определить DGо (298) реакции: Сr2О3(к) + 2Аl(к) = 2Сr(к) + Аl2О3(к), используя термодинамические величины из таблицы 4 (стр. 35). Сделать вывод: будет ли протекать самопроизвольно данная реакция в стандартных условиях?
21.Определить возможность протекания реакции в стандартных условиях: Zn (к) + 2HCl (г) = ZnCl2 (к) + H2 (г), используя термодинамические величины из таблицы 4 (стр. 35). Сделать вывод на основании расчета DGо (298) реакции.
22. Определить возможность протекания реакции в стандартных условиях: Ni (к) + 2HCl (г) = NiCl2 (к) + H2 (г). Сделать вывод на основании расчета DGо (298) реакции, используя уравнение Гиббса. Для расчета воспользоваться термодинамическими величинами из таблиц 2 (стр. 34) и 3 (стр. 35).
23. Существует много способов получения металлов. Например,
а) карботермия: WO3 (к) + 3CO(г) = W (к) + 3CO2 (г) ;
б) металлотермия: WO3 (к) + 3Cа (т) = W (к) + 3CаO (к) .
Определить: какой процесс будет легче протекать в стандартных условиях? Сделать вывод на основании расчета DGо (298) реакции, используя термодинамические величины из таблицы 4 (стр. 35).
24. Определить, возможна ли в стандартных условиях реакция получения палладиевой черни, которая применяется в качестве катализатора во многих химических процессах: PdO(т) + CO(г) = Pd (т) + CO2 (г)? Сделать вывод на основании расчета DGо (298) реакции, используя уравнение Гиббса. Для расчета использовать термодинамические величины из таблиц 2 (стр. 34) и 3 (стр. 35).
25. Мочевина (NH2)2CO используется в сельском хозяйстве в качестве азотного удобрения и как добавка в корм животным. Определить, возможен ли процесс образования мочевины в стандартных условиях по реакции:
2NH3 (г) + CO2 (г) = (NH2)2CO (т) + H2O (п)? Сделать вывод на основании расчета DGо (298) реакции, используя уравнение Гиббса. Для расчета использовать термодинамические величины из таблиц 2 (стр. 34) и 3 (стр. 35).
26. Нитрат аммония – NH4NO3 – ценное азотное удобрение. Рассчитать, возможен ли процесс получения данного удобрения в стандартных условиях по реакции: 2N2 (г) + 4H2O (п) + O2 (г) = 2NH4NO3 (т)? Использовать уравнение Гиббса и термодинамические величины из таблиц 2 (стр. 34) и 3 (стр.35).
27. Ацетилен в смеси с кислородом используют для сварки и резки металлов (автогенная сварка; температура пламени достигает 3150 оС). Ацетилен получают различными способами. Например, а) действием воды на карбид кальция: СаС2 (т) + 2Н2О (ж) = С2Н2 (г) + Са(ОН)2 (т); б) пиролизом метана: 2СН4 (г) = С2Н2 (г) + 3Н2 (г) . Рассчитать DGо (298) реакций, используя термодинамические величины из таблицы 4 (стр. 35), и сделать вывод: возможны ли они в стандартных условиях?
28. Одним из перспективных способов получения искусственного топлива является реакция: СО2 (г) + 4Н2 (г) = 2Н2О(п) + СН4 (г), DНо (298) =
= 76,8 кДж. Возможен ли данный процесс в стандартных условиях? Сделать вывод на основании расчета DSо (298), используя термодинамические величины из таблицы 3 (стр. 35), и DGо (298) реакции по уравнению Гиббса.
29. Железо под воздействием внешней среды (Н2О, О2) ржавеет, т.е. подвергается коррозии. Определить, какое состояние для железа (Feo или Fe+3) является термодинамически более устойчивым? Сделать вывод на основании расчета DGо (298) реакции: 4Fe (к) + 3О2 (г) + 6Н2О (п) = 4Fe(ОН)3(к), используя термодинамические величины из таблицы 4 (стр. 35).
30. Наиболее перспективным жидким топливом является метанол (метиловый спирт) – СН3ОН. Определить, возможен ли процесс получения метанола в стандартных условиях по реакции: СО(г) + 2Н2 (г) = СН3ОН(г),
DНо (298) = –128,1 кДж? Сделать вывод на основании расчета DSо (298), используя термодинамические величины из таблицы 3 (стр. 35), и DGо (298) реакции по уравнению Гиббса.
IV. Химическая кинетика и равновесие в гомогенных
и гетерогенных системах
Типовые задачи и их решение
1. В системе: СО(г) + Сl2(г) = COCl2(г) концентрацию СО увеличили от 0,3 до 1,2 моль/л, а концентрацию хлора – от 0,2 до 0,6 моль/л. Определить, во сколько раз возрастет скорость реакции?
Решение. На основании закона действия масс скорость гомогенной реакции (V) выражается через концентрации реагирующих веществ следующим образом:
V = k ∙ с (СО) ∙ с (Cl2),
где с (СО) – молярная концентрация оксида углерода (II), моль/л;
с (Cl2) – молярная концентрация хлора, моль/л;
k – коэффициент пропорциональности (константа скорости).
Начальная скорость: Vo = k ∙ 0,3 ∙ 0,2 = 0,06 ∙ k.
С увеличением концентраций реагирующих веществ она (V1) возрастет и составит:
V1 = k ∙ 1,2 ∙ 0,6 = 0,72 ∙ k.
Тогда: 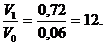
Следовательно, скорость реакции возрастет в 12 раз.
2. Определить, как изменится скорость реакции:
2NO(г) + О2(г) = 2 NO2(г), если
а) увеличить давление в системе в 3 раза;
б) повысить концентрацию NO в 3 раза?
Решение. На основании закона действия масс скорость реакции:
а) до изменения давления выражается уравнением:
Vo = k ∙ с2 (NO) ∙ с (O2).
Вследствие увеличения давления в 3 раза концентрация каждого из реагирующих веществ возросла в 3 раза. Скорость изменилась и составила:
V1 = k ∙ (3 с)2 (NO) ∙ 3 с (O2) = 27 ∙ k ∙ с2 (NO) ∙ с (O2).
Следовательно, скорость реакции возросла в 27 раз:
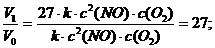
б) с повышением концентрации NO в 3 раза скорость составит:
V1 = k ∙(3 с)2(NO) ∙ с (O2) = 9 ∙ k ∙ с2(NO) ∙ с (O2).
Сравнив выражения для Vо и V1, находим, что скорость реакции возрастает в 9 раз:
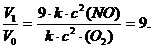
3 Определить, во сколько раз увеличится скорость химической реакции, если повысить ее температуру на 30 оС. Температурный коэффициент скорости реакции (γ) равен 3.
Решение. Согласно правилу Вант-Гоффа:

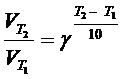
 ,
,
где Т2 – Т1 = ΔТ; ΔТ = 30. Подставим значения:

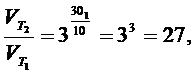
т.е. скорость реакции увеличиться в 27 раз.
4. Определить, чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 50 оС скорость реакции возрастает в 32 раза?
Решение. Согласно уравнению Вант-Гоффа:

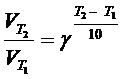 .
.
Подставим значения: 
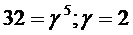 .
.
5. При 130 оС некоторая реакция заканчивается за 24 минуты. Принимая температурный коэффициент скорости реакции равным 2, рассчитать за какое время закончится эта реакция если проводить ее:
а) при 150 оС; б) при 80 оС.
Решение. Между скоростью реакции и временем ее протекания существует обратно пропорциональная зависимость:
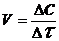 .
.
Следовательно, правило Вант-Гоффа можно записать:

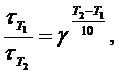
где 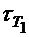 – время реакции при температуре Т1 ;
– время реакции при температуре Т1 ;
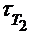 – время реакции при температуре Т2.
– время реакции при температуре Т2.
а) Т1 = 273 + 130 = 403 К; Т2 = 273 + 150 = 423 К; 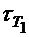 = 24 мин;
= 24 мин; 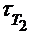 = х;
= х;
γ = 2. Подставим значения:
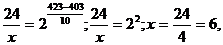
х = 6 мин,
т.е. при температуре 150 оС реакция закончится за 6 минут.
б) Т1 = 403 К; Т2 = 353 К; 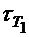 = 24 мин;
= 24 мин; 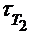 = х; γ = 2.
= х; γ = 2.
Подставим значения:
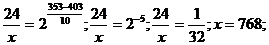
 = 768 мин = 12 час 48 мин, т.е. при температуре 80 оС реакция закончится за 12 час 48 мин.
= 768 мин = 12 час 48 мин, т.е. при температуре 80 оС реакция закончится за 12 час 48 мин.
6. При нагревании оксида азота (IV) в закрытом сосуде до некоторой температуры равновесие реакции: 2NO2(г) ↔ 2NO(г) + O2(г) устанавливается при концентрации веществ (моль/л): [NO2] = 0,3; [NO] = 1,2; [O2] = 0,6. Вычислить константу равновесия реакции для этой температуры и исходную концентрацию NO2.
Решение. Константу равновесия данной реакции рассчитывают, исходя из равновесных концентраций исходных и конечных веществ в соответсвии с законом действия масс:
[NO]2 ∙ [O2] 1,22 ∙ 0,6
[NO2]2 0,32
Поскольку к моменту установления равновесия в указанной системе образуется 1,2 моль/л NO, а по стехиометрии реакции из 2 моль NO2 образуется 2 моль NO, то количество израсходованного к этому времени оксида азота (IV) также составит 1,2 моль/л, что видно из следующей пропорции:
2 моль NO2 – 2 моль NO
Х моль NO2 – 1,2 моль NO
Х = 1,2 моль/л,
т.е. израсходованная концентрация с (NO2)изр. = 1,2 моль/л.
Исходная концентрация NO2 составит: с (NO2)исх. = [NO2] + с (NO2)изр. = 0,3 + 1,2 = 1,5 моль/л.
7. Определить, в сторону прямой или обратной реакции сместится равновесие в следующих системах:
1) 2Н2(г) + О2(г) ↔ 2Н2О(г); DНо (298) = −483,6 кДж
2) СаСО3(к) ↔ СаО(к) + СО2(г) ; DНо (298) = 179 кДж
при: а) понижении температуры; б) повышении давления.
Решение. а). Согласно принципу Ле Шателье: понижение температуры приводит к смещению химического равновесия в сторону экзотермического процесса. Поскольку первая реакция – экзотермическая (∆Но < 0), то с понижением температуры произойдет сдвиг равновесия в сторону прямой реакции. Во второй – эндотермической реакции (∆Но > 0), наоборот – в сторону обратной.
б). С повышением давления по принципу Ле Шателье должно произойти смещение равновесия в сторону образования меньшего количества молей газообразных веществ (уменьшение объема газа). В первой – гомогенной системе – смещение равновесия произойдет в сторону прямой реакции (3 объема газа → 2 объема газа), а во второй – гетерогенной – в сторону обратной реакции (0 объемов газа → 1 объем газа).
8. В равновесной системе: N2(г) + 3Н2(г) ↔ 2NH3(г) давление увеличили в 5 раз. Рассчитать, как изменятся скорости прямой и обратной реакций? В сторону какой реакции сместится равновесие?
Решение. До изменения давления в равновесной гомогенной системе скорость прямой реакции в соответствии с законом действия масс выражается уравнением:
Vо = k1 ∙ [N2] ∙ [H2]3; Vо = k2 ∙ [NH3]2.
С увеличением давления в 5 раз скорость изменилась и составила:
V1 = k1 ∙ [5N2] ∙ [5H2]3 = 625 ∙ k1 ∙ [N2] ∙ [H2]3;
V1 = k2 ∙ [5NH3]2 = 25 ∙ k2 ∙ [NH3]2.
Сравнивая скорости прямой и обратной реакций, делаем вывод: скорость прямой реакции при повышении давления в гомогенной равновесной системе в 5 раз увеличилась в 25 раз (625/25).
Следовательно, с увеличением давления равновесие в системе сместится в сторону прямой реакции.
9. Процесс образования хлорида аммония обратим: NH3 (г) + HCl (г) ↔ ↔ NH4Cl (к) ; DНо (298) = −176,2 кДж; DGо (298) = −91,7 кДж. Выразить и рассчитать константу равновесия (Кс) этой обратимой реакции. Определить, как повлияет: а) увеличение давления; б) уменьшение температуры на смещение равновесия в этой системе?
Решение. Выражение константы обратимой гетерогенной реакции имеет вид:
[NH3] ∙ [HCl]
где [NH4Cl] = 1, т.к. кристаллическое вещество.
Уравнение связи константы равновесия и энергии Гиббса:
DGо (298) = −5,71 ∙ lg Кс.
Подставляем значения и определяем Кс:
−91,7 = −5,71 ∙ lg Кс. Получаем: lg Кс ≈ 16. Откуда Кс = 1016.
Большое значение константы равновесия показывает, что при стандартной температуре равновесие реакции сильно смещено вправо.
При увеличении давления равновесие будет смещаться вправо, т.к. прямая реакция протекает с уменьшением давления (2 объема газа → 0 объемов газа). При уменьшении температуры равновесие также будет смещаться вправо, т.к. прямая реакция – экзотермическая (DНо (298) = −176,2 кДж).
IV. 1. Зависимость скорости химической
реакции от температуры
Контрольные задачи
1. Температурный коэффициент скорости реакции равен 2. При 20 оС скорость реакции составляет 0,04 моль/л∙ч. Какова скорость этой реакции при: а) 40 оС; б) 0 оС?
2. При 30 оС скорость химической реакции равна 0,01 моль/л∙мин. Какова она при а) 0 оС; б) 60 оС, если температурный коэффициент скорости реакции равен 3?
3. При 40 оС скорость химической реакции составляет 0,2 моль/л∙ч. Какова она при: а) 10 оС; б) 100 оС, если температурный коэффициент скорости реакции равен 2?
4. Температурный коэффициент скорости реакции равен 3. При 50 оС скорость реакции составляет 0,05 моль/л∙мин. Какова скорость этой реакции при: а)20 оС; б) 70 оС?
5. Во сколько раз возрастёт скорость химической реакции при повышении температуры с 10 до 60 оС, если температурный коэффициент скорости реакции равен 3?
6.Температурный коэффициент скорости реакции равен 3. Во сколько раз возрастёт скорость этой реакции при увеличении температуры на 100 оС?
7. Реакция при 50 оС заканчивается за 2 мин 15 с. Через какой отрезок времени закончится эта реакция при 70 оС, если температурный коэффициент скорости реакции равен 3?
8. При 20 оС реакция протекает за 2 мин. Сколько времени будет протекать эта реакция при: а) 0 оС; б) 50 оС? Температурный коэффициент скорости реакции равен 2.
9. На сколько градусов следует увеличить температуру, чтобы скорость реакции возросла в 27 раз? Температурный коэффициент скорости реакции равен 3.
10. При 30 оС реакция заканчивается за 25 мин, при 50 оС - за 4 мин. Рассчитать температурный коэффициент скорости реакции.
11. Скорость реакции при 0 оС равна 1 моль/л∙с. Вычислить скорость этой реакции при 30 оС, если температурный коэффициент скорости реакции равен 3.
12. Температурный коэффициент скорости реакции равен 2. Во сколько раз возрастёт скорость этой реакции при увеличении температуры на:
а) 30 оС; б) 50 оС?
13. Во сколько раз уменьшится скорость химической реакции при понижении температуры на: а) 20 оС; б) 40 оС? Температурный коэффициент скорости реакции равен 3.
14. На сколько градусов следует повысить температуру, чтобы скорость химической реакции возросла в 16 раз? Температурный коэффициент скорости реакции равен 2.
15. При повышении температуры на 60 оС скорость химической реакции возросла в 64 раза. Вычислить температурный коэффициент скорости реакции.
16. Скорость химической реакции возросла в 81 раз. Температурный коэффициент скорости реакции равен 3. На сколько градусов была повышена температура?
17. При 10 оС реакция заканчивается за 120 секунд, а при 20 оС - за 60 секунд. Чему равен температурный коэффициент скорости реакции?
18. Реакция при 20 оС протекает за 90 секунд. Сколько времени потребуется для завершения этой реакции при 40 оС, если температурный коэффициент скорости реакции равен 3?
19. Скорость химической реакции при 40 оС равна 1 моль/л∙с. Вычислить скорость этой реакции при 80 оС, если температурный коэффициент скорости реакции равен 4.
20. При увеличении температуры на 50 оС скорость химической реакции возросла в 1024 раз. Вычислить температурный коэффициент скорости реакции.
21. Во сколько раз уменьшится скорость химической реакции, если температуру газовой смеси понизить от 140 до 100 оС? Температурный коэффициент скорости реакции равен 3.
22. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 64раза. Температурный коэффициент скорости реакции равен 4.
23. При 30 оС реакция заканчивается за 4 мин, а при 10 оС - за 16 мин. Вычислить температурный коэффициент скорости реакции. Сколько времени потребуется на прохождение этой реакции при 20 оС?
24. При повышении температуры на 20 оС скорость реакции возросла в 9 раз. Вычислить температурный коэффициент скорости реакции.
25. Температурный коэффициент скорости реакции равен 4. При 30 оС скорость реакции составляет 0,02 моль/л∙мин. Какова скорость этой реакции при: а) 0 оС; б) 50 оС?
26.Как изменится скорость химической реакции при понижении температуры с 80 оС до 20 оС, если температурный коэффициент скорости реакции равен 3?
27.Реакция при 60 оС заканчивается за 1 мин 30 сек. Сколько времени потребуется для окончания данной реакции при 80 оС, если температурный коэффициент скорости реакции равен 3?
28.Во сколько раз уменьшится скорость химической реакции, если температуру газовой смеси понизить от 40 оС до 0 оС? Температурный коэффициент скорости реакции равен 2.
29.На сколько градусов следует понизить температуру, чтобы скорость химической реакции уменьшилась в 27 раз? Температурный коэффициент скорости реакции равен 3.
30.При 30 оС реакция заканчивается за 4 мин. Температурный коэффициент скорости реакции равен 2. Сколько времени потребуется на прохождение этой реакции при 10 оС?
