Распределение молекул по энергиям
Элементарный акт химической реакции происходит не при любом столкновении молекул, а только при столкновении молекул, которые обладают повышенным запасом кинетической энергии. Молекулы, обладающие такой энергией, называются активными молекулами.
На рис. 4.4 показано распределение молекул идеального газа по кинетической энергии согласно статистическому закону Максвелла-Больцмана при двух разных температурах.
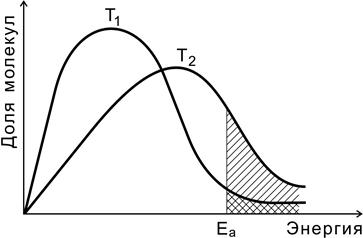
Рис. 4.4. Распределение молекул по энергиям
при двух разных температурах (Т2 > Т1)
Доля молекул с энергией, превышающей энергию активации Еа (доля активных молекул), с повышением температуры резко возрастает (площадь заштрихованной области).
Величина 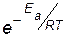 в уравнении Аррениуса (4.12) численно равна доле активных молекул.
в уравнении Аррениуса (4.12) численно равна доле активных молекул.
Чем выше температура, тем больше в системе активных молекул, тем выше скорость реакции.
Энтропия активации. Стерический фактор
Кроме энергии активации, важным условием осуществления химической реакции является ориентация молекул в момент столкновения.
Большую роль играют размеры и форма молекул, место расположения реакционно-способных атомов или групп атомов в молекуле.
Энтропия активации (в расчете на 1 моль) по уравнению Больцмана:
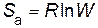 .
.
Вероятность необходимой ориентации:
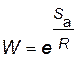 .
.
Чем больше вероятность необходимой для реакции ориентации, т.е. чем больше значение энтропии активации и чем меньше значение энергии активации, тем выше скорость реакции и, соответственно, константа скорости:
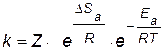 , , | (4.13) |
где Z – коэффициент пропорциональности.
Для бимолекулярных реакций Z – это число столкновений частиц в единице объема за единицу времени (1 см3, 1с).
Уравнение (4.13) называют основным уравнением химической кинетики. Энергия активации и энтропия активации являются теми факторами, посредством которых сказывается влияние природы реагирующих веществ на скорость реакции.
Множитель 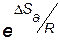 называется стерическим фактором (или стерическим множителем, или фактором вероятности).
называется стерическим фактором (или стерическим множителем, или фактором вероятности).
Стерический фактор 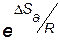 и частота столкновений Z учитываются в уравнении Аррениуса (4.12) через предэкспоненциальный множитель А.
и частота столкновений Z учитываются в уравнении Аррениуса (4.12) через предэкспоненциальный множитель А.
Расчет энергии активации
Энергию активации можно рассчитать по экспериментальным данным графическим или аналитическим способами, используя уравнение Аррениуса
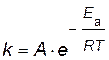 ,
,
представив его в логарифмическом виде
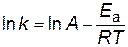 . . | (4.14) |
Графический способ. По экспериментальным значениям константы скорости реакции при различных температурах строят график зависимости lnk=f ( 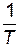 ) (рис. 4.5).
) (рис. 4.5).
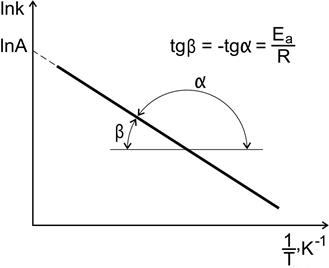
Рис. 4.5. Зависимость константы скорости реакции от температуры
По тангенсу угла наклона прямой к оси абсцисс вычисляют энергию активации
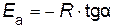 .
.
Аналитический способ. Если предположить, что для выбранной реакции величины А и Еа постоянны в небольших пределах температур от Т1 до Т2, то:
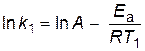 ;
;
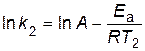 .
.
В результате вычитания первого уравнения из второго получим
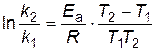 . . | (4.15) |
Следовательно:
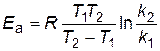 . . | (4.16) |
Под символом логарифма находится отношение констант скоростей реакции при двух температурах, поэтому константы можно заменить любыми пропорциональными им величинами при тех же температурах. Например, вместо констант скоростей можно подставить скорости реакции, если исходные концентрации реагирующих веществ при измерении скоростей в обоих опытах были одинаковы и скорость изменилась только под влиянием изменения температуры. Тогда получим следующие выражения:
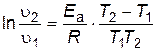 ; ; | (4.17) | ||
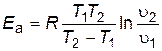 . . | (4.18) | ||
Каталитические реакции
Катализаторы – вещества, изменяющие скорость реакции и остающиеся к концу реакции химически неизменными.
Явление изменения скорости реакции под действием таких веществ называется катализом.
Сущность каталитического действия.
Катализ обусловлен промежуточным химическим взаимодействием реагирующих веществ с катализатором, в результате которого открывается новый реакционный путь. Ускорение процессов с помощью катализаторов достигается за счет того, что появляются новые механизмы, при которых медленные стадии заменяются более быстрыми.
Реакция превращения веществ А и В в вещество АВ с участием катализатора К осуществляется по следующей схеме:
A + K ® AK
AK + B ® AB + K
A + B ® AB.
Независимо от механизма действия роль катализатора с точки зрения энергетики реакции сводится, как показано на рис. 4.6, кснижению энергии активации (Еа кат < Еа ), за счет чего увеличивается константа скорости реакции.
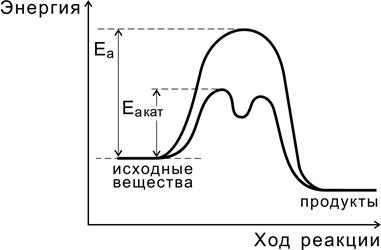
Рис.4.6. Реакция с участием катализатора
Катализатор может также способствовать необходимой для взаимодействия молекул ориентации. Катализатор не влияет на константу химического равновесия и не смещает положение химического равновесия. Энергия активации прямой и обратной реакций при введении катализатора уменьшается на одинаковую величину. Катализатор ускоряет прямую и обратную реакции, т.е. сокращает время достижения равновесия при подходе к нему как со стороны исходных веществ, так и со стороны продуктов.
По фазовому принципу различают гомогенный и гетерогенный катализ.
Гомогенный катализ.Гомогенным называют катализ, при котором катализатор и реагирующие вещества находятся в одной фазе (газовой или жидкой). Примером гомогенногогазофазного каталитического процесса может служить окисление диоксида серы SO2 до триоксида SO3. Без катализатора диоксид серы очень медленно окисляется кислородом.
При производстве серной кислоты камерным способом процесс окисления диоксида серы до триоксида катализируется оксидом азота (II), который открывает для реакции новый путь, не включающий медленной стадии взаимодействия диоксида серы с молекулярным кислородом
2SO2(г) + О2(г)  2SO3(г).
2SO3(г).
Катализатор NO вступает в реакцию с кислородом О2 , образуя промежуточный продукт NO2:
2NO(г) + O2(г) =2NO2(г).
NO2 затем реагирует с SO2 по реакции
2SO2(г) + 2NO2(г) = 2SO3(г) + 2NO(г),
в результате которой получается конечный продукт и выделяется катализатор в химически неизменном виде и первоначальном количестве.
К преимуществам гомогенного катализа можно отнести высокую эффективность действия катализаторов, так как реакция идет во всем объеме сосуда. Но практическое выделение продуктов из реакционной смеси может быть затруднено.
Гетерогенный катализ.Гетерогенным называют катализ, при котором катализатор и реагирующие вещества находятся в разных фазах. Процесс идет на границе раздела фаз. Обычно в качестве катализатора используется твердое вещество и взаимодействие протекает на его поверхности, а реагенты находятся в газовой или жидкой фазах. Активность гетерогенного катализатора зависит от величины и свойств его поверхности. Обычно применяют тонко измельченные порошки, пористые структуры с высокоразвитой поверхностью, в том числе пористые носители с нанесенным слоем катализатора.
Во многих случаях гетерогенный катализ протекает с помощью переходных металлов и их соединений (Pt, Pd, Rh, Fe, Ni, CuO, V2O5, NiO, Fe2O3, Cr2O3 и др.).
Примером гетерогенного катализа является вышерассмотренная реакция окисления диоксида серы SO2 до триоксида SO3, но уже в присутствии твердого катализатора V2O5 или Pt
2SO2(г) + O2(г) 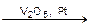 2SO3(г).
2SO3(г).
Гетерогенный катализ удобен тем, что катализатор не смешивается с реагентами, поэтому не возникает проблемы отделения его от продуктов реакции. Но с течением времени активная поверхность твердых катализаторов может измениться.
Химическое равновесие
4.14.1. Состояние равновесия
Реакции, протекающие при одних и тех же условиях одновременно в противоположных направлениях, называютсяобратимыми.
Рассмотрим простую обратимую реакцию, которая протекает в закрытой системе
A + B « C + D.
Скорость прямой реакции описывается уравнением
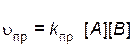 ,
,
где 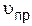 – скорость прямой реакции;
– скорость прямой реакции; 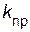 – константа скорости прямой реакции.
– константа скорости прямой реакции.
С течением времени концентрации реагентов А и В уменьшаются, скорость реакции снижается (рис.4.7, кривая 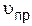 ).
).
Реакция между А и В приводит к образованию веществ C и D, молекулы которых при столкновениях могут вновь дать вещества А и В.
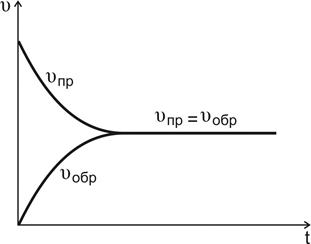
Рис. 4.7. Изменение скоростей прямой и обратной реакций во времени
Скорость обратной реакции описывается уравнением
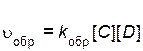 ,
,
где 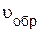 – скорость обратной реакции;
– скорость обратной реакции; 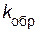 – константа скорости обратной реакции.
– константа скорости обратной реакции.
По мере того как концентрации веществ C и D возрастают, скорость обратной реакции увеличивается (рис.4.7, кривая 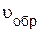 ).
).
В какой-то момент времени скорости прямой и обратной реакций становятся равными
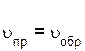 .
.
Такое состояние системы называется состоянием равновесия.
В состоянии равновесия концентрации всех его участников перестают меняться во времени. Такие концентрации называются равновесными.
Равенство скоростей прямой и обратной реакций – это кинетическое условие химического равновесия.
4.14.2. Константа равновесия
При равенстве скоростей прямой и обратной реакций
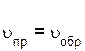
справедливо равенство
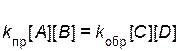 ,
,
где [A], [B], [С], [D] – равновесные концентрации веществ.
Поскольку константы скоростей не зависят от концентраций, равенство можно записать иначе:
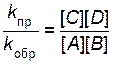 .
.
Отношение констант скоростей прямой и обратной реакций
( 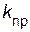 /
/ 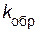 ) называют константой химического равновесия:
) называют константой химического равновесия:
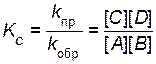 . . | (4.19) |
Константа равновесия является постоянной величиной для данной реакции при данной температуре. Величина константы равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации реагирующих веществ.Она показывает соотношение между концентрациями продуктов реакции и исходных веществ, которое устанавливается при равновесии.
Рассмотрим сложную реакцию
aA + bB « cC + dD.
Любую сложную химическую реакцию можно представить в виде ряда простых реакций. Для каждой из простых реакций можно записать кинетическое уравнение прямой и обратной реакций и соответствующие им выражения для констант равновесия. Константа равновесия сложной реакции равна произведению констант равновесия простых реакций, описывающих ее механизм
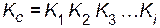 .
.
Поэтому в суммарное выражение для константы равновесия равновесные концентрации войдут в степенях их стехиометрических коэффициентов:
