Карбонильные соединения альдегиды и кетоны
Органические соединения, молекулы которых содержат карбонильную группу  , называются карбонильными соединениями. В зависимости от характера связанных с карбонильной группой заместителей карбонильные соединения делятся на альдегиды, кетоны, карбоновые кислоты и их функциональные производные.
, называются карбонильными соединениями. В зависимости от характера связанных с карбонильной группой заместителей карбонильные соединения делятся на альдегиды, кетоны, карбоновые кислоты и их функциональные производные.
АЛЬДЕГИДЫ
Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода, то есть общая формула альдегидов 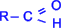 . Исключение составляет муравьиный альдегид
. Исключение составляет муравьиный альдегид 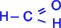 , в котором, как видно, R=H.
, в котором, как видно, R=H.
Изомерия
Для альдегидов характерна изомерия углеводородного радикала, который может иметь как нормальную (неразветвленную) цепь, так и разветвленную, а также межклассовая изомерия с кетонами. Например,
| O II CH3–CH2–CH2–C I H | O II CH3–CH–C I I H CH3 | O II CH3–CH2–C | –CH3 |
| масляный альдегид или бутаналь | изомасляный альдегид или 2-метил-пропаналь | метилэтилкетон или бутанон -2 |
Получение
1. Наиболее часто применяющимися способами получения альдегидов являются окисление и каталитическое дегидрирование первичных спиртов.
a) Окисление первичных спиртов.
Как видно, при дальнейшем окислении образуются кислоты. Эти реакции приводились уже при рассмотрении химических свойств спиртов.
b) Дегидрирование первичных спиртов. Реакцию проводят, пропуская пары спирта над нагретым до 200-300°С катализатором, в качестве которого используются медь, никель, кобальт и др.
| O II R–CH2–OH ––t°,kat® R–C I H | (альдегид) + H2 |
2. Разработан метод получения уксусного альдегида окислением этилена кислородом воздуха в присутствии солей меди и палладия.
| O II 2CH2=CH2 + O2 ––CuCl2,PbCl2® 2CH3–C I H уксусный альдегид |
3. Уксусный альдегид получают гидратацией ацетилена по реакции Кучерова.
| O II | ||
| HCºCH + H2O ––HgSO4® [H2 | C=C | H] ––® CH3–C |
 вини- ловый спирт вини- ловый спирт | I H уксусный альдегид |
Подробно реакция Кучерова уже рассматривалась при изучении химических свойств ацетиленовых углеводородов.
4. Альдегиды получают гидролизом дигалогенопроизводных углеводородов, однако только тех, у которых оба атома галогена расположены у одного из концевых атомов углерода.
| CH3–CH2– | 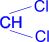 | + 2H2O ® [CH3–CH2– | 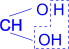 | ] + 2HCl |
| 1,1- дихлорпропан | 1,1-пропандиол | | ¯ |
| O II CH3–CH2–C I H | + H2O |
| пропаналь |
При действии воды на дигалогеналкил в щелочной или кислой среде реакция его гидролиза проходит стадию образования двухатомного спирта, содержащего две гидроксильных группы у одного атома углерода.
Такие спирты вследствие своей неустойчивости в момент образования теряют воду и образуют альдегиды.
Физические свойства
Простейший альдегид – муравьиный – газ с весьма резким запахом. Другие низшие альдегиды – жидкости, хорошо растворимые в воде. Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в альдегидах водородных связей. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Физические свойства некоторых альдегидов представлены в таблице.
Таблица. Физические свойства некоторых альдегидов
| Название | Формула | t°кип., °C | t°пл., °C | d420 |
| Муравьиный альдегид | O II H–C I H | -92,0 | -21,0 | 0,815 (при 20°С) |
| Уксусный альдегид | O II CH3–C I H | -123,5 | 21,0 | 0,780 |
| Пропионовый альдегид | O II CH3–CH2–C I H | -102,0 | 48,8 | 0,807 |
| Масляный альдегид | O II CH3–CH2–CH2–C I H | -99,0 | 75,7 | 0,817 |
| Изомасляный альдегид | O II CH3–CH–C I I CH3 H | -65,9 | 64,0 | 0,794 |
Химические свойства
Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы. Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три s- связи (одна из них – связь С–О), которые расположены в одной плоскости под углом 120° друг к другу.
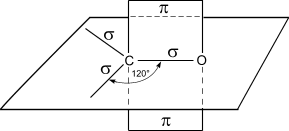
Схема строения карбонильной группы
Двойная связь карбонильной группы по физической природе сходна с двойной связью между углеродными атомами, т. е. это сочетание s- и p- связей, последняя из которых образована р- электронами атомов углерода и кислорода. Ввиду большей электроотрицательности атома кислорода по сравнению с атомом углерода, связь С=О сильно поляризована за счет смещения электронной плотности p- связи к атому кислорода, в результате чего на атоме кислорода возникает частичный отрицательный (d-), а на атоме углерода – частичный положительный (d+) заряды: 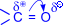 .
.
Благодаря поляризации атом углерода карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Важнейшими реакциями альдегидов являются реакции нуклеофильного присоединения по двойной связи карбонильной группы.
1. Одной из типичных реакций нуклеофильного присоединения альдегидов является присоединение синильной (циановодородной) кислоты, приводящее к образованию a- оксинитрилов.
| CH3– | 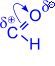 | +  | OH I ––KCN® CH3–C–CN I H | |
Эта реакция используется для удлинения углеродной цепи и получения a- оксикислот.
2. Присоединение гидросульфита натрия дает кристаллические вещества, обычно называемые гидросульфитными производными альдегидов.
| O II CH3–C I H | + HSO3Na ® CH3– | OH I C–SO3Na (гидросульфитное производное уксусного альдегида) I H |
Упомянутые производные легко гидролизуются в любых средах, приводя к исходному карбонильному соединению. Так, при нагревании с раствором соды гидросульфитного производного уксусного альдегида образуется собственно уксусный альдегид.
| 2CH3– | OH I C–SO3Na + Na2CO3 ® 2CH3– I H | O II C + 2Na2SO3 + CO2 + H2O I H |
Данное свойство используется для очистки альдегидов и выделения их из смесей.
3. Присоединение спиртов к альдегидам приводит к образованию полуацеталей – соединений, в которых атом углерода связан и с гидроксильной (–ОН), и с алкоксильной (–ОR) группами.
| R– | 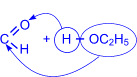 | OH I « R–CH I OC2H5 (полуацеталь) |
При обработке полуацеталей избытком спирта в кислой среде образуются ацетали – соединения, в которых атом углерода связан с двумя алкоксильными группами (реакция напоминает синтез простых эфиров из спиртов).
| R– | 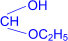 полуацеталь полуацеталь | + H–OC2H5 | H+® | R– | 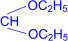 ацеталь ацеталь | + H2O |
В отличие от простых эфиров ацетали гидролизуются под действием кислот с образованием спирта и альдегида.
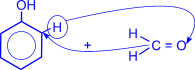
4. Присоединение водорода к альдегидам осуществляется в присутствии катализаторов (Ni, Co, Pd и др.) и приводит к образованию первичных спиртов.
| O II R–C + H2 ––Ni® R–CH2–OH(первичный спирт) I H |
Все чаще в качестве восстанавливающего агента применяют алюмогидрид лития LiAlH4 и борогидрид натрия NaBH4.
Помимо реакций присоединения по карбонильной группе для альдегидов характерны также реакции окисления.
5. Окисление. Альдегиды легко окисляются, образуя соответствующие карбоновые кислоты.
| O II R–C I H | ––[O]® | O II R–C (кислота) I OH |
a) аммиачный раствор оксида серебра [Ag(NH3)2]OH при нагревании с альдегидами окисляет альдегид до кислоты (в виде ее аммониевой соли) с образованием свободного металлического серебра. Восстановленное серебро ложится тонким слоем на стенки химического сосуда, в котором осуществляется реакция, и получается серебряное зеркало. Эта реакция, получившая поэтому название "серебряного зеркала", служит качественной реакцией на альдегиды.
| O II CH3–C+ 2[Ag(NH3)2OH ––t°® CH3COONH4(ацетат аммония) + 2Ag¯ + 3NH3 + H2O I H |
b) еще одной характерной реакцией является окисление альдегидов гидроксидом меди (II).
| O II CH3–C I H | + 2Cu(OH)2(голубой) ––t°® CH3– | O II C (уксусная к-та) + Cu2O¯(красный) +2H2O I OH |
При нагревании голубого гидроксида меди (II) с раствором уксусного альдегида выпадает красный осадок оксида меди (I). При этом уксусный альдегид окисляется до уксусной кислоты, а медь со степенью окисления +2 восстанавливается до меди со степенью окисления +1. Муравьиный альдегид (формальдегид) занимает особое место в ряду альдегидов. В связи с отсутствием у муравьиного альдегида радикала, ему присущи некоторые специфические свойства. Окисление формальдегида, например, осуществляется до двуокиси углерода СО2.
Формальдегид легко полимеризуется с образованием циклических и линейных полимеров. Так, в кислой среде он образует циклический тример – триоксиметилен.
 | =O | H+ –® | 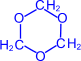 (триоксиметилен) (триоксиметилен) |
Сухой газообразный формальдегид в присутствии катализаторов образует высокомолекулярный полиформальдегид. Полимеризация формальдегида напоминает полимеризацию алкенов.
 | =O + |  | =O ––kat® | H I …–C I H | H I –O–C–O–… I H | 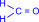 –––––® –––––® | …–H2C–O |
В водных растворах формальдегид образует полимер, называемый параформом.
n CH2 = O + H2O ® HOCH2(OCH2)n-2OCH2OH
(параформ)
Особое практическое значение имеет реакция поликонденсации формальдегида с фенолом с образованием фенолформальдегидных смол. При действии щелочных или кислых катализаторов на смесь фенола и формальдегида конденсация идет в орто- и пара- положениях.
 | H+ или OH- | 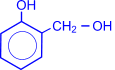 |
| –––––––––––––® |
Рост молекулы за счет конденсации фенола с формальдегидом осуществляется при нормальной температуре в линейном направлении.
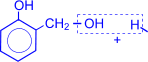 |  | ® H2O + |  |  |
 |  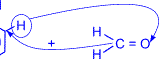 | ® |  |  | CH2OH / |
и т. д.
Суммарно реакцию поликонденсации фенола с формальдегидом можно изобразить следующим образом:
| n | 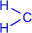 | = O + (n+1) |  | катализатор |  | 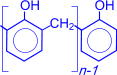 | + nH2O |
| ––––––––® |
Фенолформальдегидные смолы – первенцы промышленных синтетических смол, их производство под названием "бакелит" впервые начато в 1909 году. Фенолформальдегидные смолы используются в производстве различных пластмасс. В сочетании с различными наполнителями такие пластмассы называются фенопластами. Кроме того, фенолформальдегидные смолы применяются при изготовлении различных клеев и лаков, термоизоляционных материалов, древесных пластиков, литейных форм и др.
Применение
Уже много упомянуто о применении формальдегида. Кроме того, он используется для получения карбамидных смол при взаимодействии с мочевиной, на основе которых производятся пластмассы, необходимые для нужд электротехники. Растворы формальдегида (формалин) используются в кожевенной промышленности для дубления кож, для дезинфекции зерно- и овощехранилищ, теплиц, парников, для протравливания семян перед посевом, для хранения анатомических препаратов, а также в производстве некоторых лекарственных препаратов.
Уксусный альдегид является исходным сырьем для получения в промышленном масштабе уксусной кислоты, уксусного ангидрида, этилового спирта, этилацетата и других ценных продуктов, а при конденсации с аминами и фенолами – различных синтетических смол.
КЕТОНЫ
Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами. Общая формула кетонов  , где R может совпадать с R'.
, где R может совпадать с R'.
Изомерия
Для кетонов характерна изомерия углеводородных радикалов, изомерия положения карбонильной группы и межклассовая изомерия с альдегидами.
Получение
Почти все способы получения, приведенные ранее для альдегидов (см. "Альдегиды. Получение"), применимы и для кетонов.
1. Окисление вторичных спиртов.
| R \ CH–OH(вторичный спирт) –– [O]® / R’ | R \ C=O(кетон) + H2O / R’ |
2. Дегидрирование вторичных спиртов.
| R \ CH–OH(вторичный спирт) ––kat® / R’ | R \ C=O(кетон) + H2 / R’ |
3. Гидратация гомологов ацетилена (реакция Кучерова).
| R–CºCH + H–OH –HgSO4® [R– | C–CH2] ® R– I ø OH | C–CH3 II O |
4. Гидролиз дигалогенопроизводных углеводородов, содержащих оба атома галогена у одного из средних в цепи углеродных атомов.
| CH3– | Cl I C–CH3(2,2- дихлорпропан) + 2H2O ® [CH3– I Cl |  | CH3](2,2- пропандиол) + 2HCl |
| ¯ | |||
| CH3– | O II C–CH3 + H2O(диметилкетон (ацетон)) |
5. Кетоны получают, кроме того, пиролизом кальциевых солей карбоновых кислот при их нагревании.
| O II CH3–C I O | O | |
| \ Ca(уксуснокислый кальций) – t°® CH3– / | II C–CH3 + CaCO3 | |
| O II CH3–C I O |
Физические свойства
Низшие кетоны – жидкости, легко растворимые в воде. В основном, кетоны обладают приятным запахом, напоминающим запах цветов. Как и альдегиды, кетоны кипят при более низкой температуре, чем соответствующие спирты, однако выше, чем углеводороды. Физические свойства некоторых кетонов представлены в таблице.
Таблица. Физические свойства некоторых кетонов
| Название | Формула | t°пл., °C | t°кип., °C | d420 |
| Ацетон (диметилкетон) | CH3– 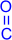 –CH3 –CH3 | -95,35 | 56,2 | 0,790 |
| Метилэтилкетон | CH3– 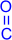 –CH2–CH3 –CH2–CH3 | -86,4 | 79,6 | 0,805 |
| Метилпропилкетон | CH3– 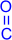 –CH2–CH2–CH3 –CH2–CH2–CH3 | -77,8 | 101,7 | 0,809 |
| Диэтилкетон | CH3–CH2– 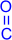 –CH2–CH3 –CH2–CH3 | -42,0 | 102,7 | 0,816 |
Химические свойства
Как и альдегиды, кетоны характеризуются высокой реакционной способностью. Химическая активность альдегидов и кетонов тем выше, чем больше положительный заряд на атоме углерода карбонильной группы. Радикалы, увеличивающие этот положительный заряд, резко повышают реакционную способность альдегидов и кетонов, а радикалы, уменьшающие поло-жительный заряд, оказывают противоположное действие. В кетонах две алкильные группы являются электронодонорными, откуда становится понятным, почему кетоны менее активны в реакциях нуклеофильного присоединения по сравнению с альдегидами.
Примеры реакций этого типа для альдегидов подробно рассмотрены ранее (см. "Альдегиды. Химические свойства"), поэтому, приводя некоторые примеры реакций нуклеофильного присоединения по карбонильной группе кетонов, уделим внимание лишь отличиям их химических свойств от альдегидов.
1. Присоединение синильной кислоты.
| R \ C=O(кетон) + H– CN –KCN® CH3– / R’ | OH I C–CN(нитрил a-оксиизомасляной кислоты) I CH3 |
2. Присоединение гидросульфита натрия.
| R \ C=O(кетон) + HSO3Na ® R– / R’ | OH I C–SO3Na(гидросульфитное производное кетона) I R’ |
Следует отметить, что в реакцию с гидросульфитом натрия вступают только метилкетоны, т. е. кетоны, имеющие группировку CH3.
3. По сравнению с альдегидами для кетонов не характерны реакции со спиртами.
4. Присоединение водорода. Присоединение водорода к кетонам приводит к образованию вторичных спиртов.
| R \ C=O(кетон) + H2 –Ni® / R’ | R \ CH–OH(вторичный спирт) / R’ |
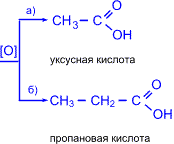
5. Кетоны окисляются значительно труднее, чем альдегиды. Кислород воздуха и слабые окислители не окисляют кетоны. Кетоны не дают реакции "серебряного зеркала" и не реагируют с гидроксидом меди (II). При действии сильных окислителей в жестких условиях углеродная цепь молекулы кетона разрушается рядом с карбонильной группой и образуются кислоты (иногда кетоны в зависимости от строения исходного кетона) с меньшим числом атомов углерода.
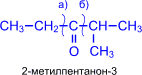 |  | 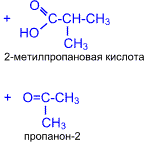 |
Применение
Наиболее широкое промышленное применение имеет простейший представитель кетонов – ацетон. Ацетон является ценным растворителем, использующимся в лакокрасочной промышленности, в производстве искусственного шелка, кинопленки,бездымного пороха. Он служит также исходным сырьем при производстве метакриловой кислоты, метилметакрилата (производство небьющегося органического стекла), метилизобутилкетона и др.
