Кинетические представления о химическом равновесии
Если при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают необратимой, протекающей до конца.
К необратимым принято относить взаимодействия между веществами, в результате которых образуются осадки, газы и малодиссоциирующие вещества.
BaCl2 + H2SO4 = Ba SO4↓ + 2HCl
Na2CO3 + 2HNO3 = Na NO3 + H2CO3 (CO2↑ + H2O)
KOH + HCl = KCl + H2O
Множество химических реакций протекает обратимо. Их особенность состоит в том, что они не идут до конца, в системе всегда остается каждое из исходных веществ. Например, реакция получения йодистого водорода
H2 + J2 ↔ 2HJ
Реакцию, протекающую вправо, называют прямой, а влево - обратной. Если в системе скорость прямой реакции V равна скорости обратной реакции V, состояние системы называется химическим равновесием. Таким образом, кинетическим условием химического равновесия является равенство
Vпр = Vобр.
Если равенство скоростей является кинетическим условием равновесия, то равенство (DG)р,т = 0 - термодинамическим условием химического равновесия. Если (DG)р,т = 0, скорость прямой реакции Vпр при данных р и Т равна скорости обратной реакции Vобр.
Неравенству (DG)р,т < 0 отвечает неравенствоVпр > Vобр, при этом самопроизвольно идет прямая реакция и в системе накапливаются продукты реакции.
Когда (DG)р,т >0, Vпр < Vобр. Самопроизвольно при этом идет обратный процесс, и концентрация продуктов реакции в системе понижается.
Химическое равновесие характеризуется постоянным и вполне определенным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия химической реакции и обозначается КC.
Для обратимой реакции, протекающей в гомогенной системе (где все вещества жидкости или газы),
аА + dB ↔ mM + nN
константа равновесия имеет вид
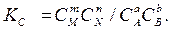 .
.
Выражение является записью закона действующих масс для обратимых реакций. Его можно вывести исходя из кинетических представлений. По закону действующих масс при равновесии Vпр = Vобр, тогда
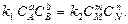
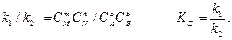
При заданной температуре константа равновесия химической реакции равна отношению констант скоростей прямого и обратного процессов. Константа равновесия так же, как и константы скоростей к1 и к2, зависит от природы реагентов, температуры и не зависит от исходных концентраций в системе.
Рассмотрим изменение скорости прямой и обратной реакций во времени
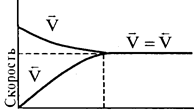
Рис. 3.5.
В начале скорость прямой реакции max, а скорость обратной реакции равна 0. По мере накопления продуктов концентрации исходных веществ уменьшаются, т.е.скорость прямой реакции уменьшаются, а скорость обратной реакции увеличивается.
В какой-то момент скорость прямой реакции равна скорости обратной реакции. При равновесии концентрации всех веществ связаны. Изменение концентрации любого вещества приводит к изменению концентрации остальных. Устанавливается новое равновесие, но КC = const.
Если в реакции участвуют газообразные вещества, то концентрации газообразных веществ в выражении могут быть сменены равновесными парциальными давлениями этих веществ:
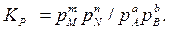
Если обратимая реакция протекает в гетерогенной системе, то константа равновесия Кр равна отношению равновесных парциальных давлении газообразных веществ и не зависит от абсолютного и относительного количеств веществ, находящихся в конденсированном виде. КC и Кр связаны выражением:
Кр = КC ( R T ) Dn,
где Dn – изменение количества молей газообразных веществ в процессе реакции.
Величина КC показывает выход продукта. Если КC >> 1 – выход велик, если же КC << 1 – продукта мало.
9.вопрос
Переход химической системы из одного равновесного состояния в другое называется смещением (сдвигом) равновесия. В силу динамического характера химического равновесия оно оказывается чувствительным к внешним условиям и способно реагировать на их изменение.
Направление смещения положения химического равновесия в результате изменения внешних условий определяется правилом, впервые сформулированным французским химиком и металловедом Анри Луи Ле Шателье в 1884 году и названным в его честьпринципом Ле Шателье:
Если на систему, находящуюся в состоянии равновесия, оказывают внешнее воздействие, то в системе происходит такое смещение равновесия, которое ослабляет это воздействие.
Существует три основных параметра, изменяя которые, можно смещать химическое равновесие. Это – температура, давление и концентрация. Рассмотрим их влияние на примере равновесной реакции:
| 2NO (Г) + O2 (Г) = 2NO2 (Г). | DH° = -114.5 кДж |
1) Влияние температуры. Поскольку для данной реакции DH°<0, следовательно, прямая реакция идет с выделением тепла (+Q), а обратная реакция – с поглощением тепла (-Q):
+Q
2NO (Г) + O2 (Г)  2NO2 (Г)
2NO2 (Г)
-Q
При повышении температуры, т.е. при внесении в систему дополнительной энергии, равновесие смещается в сторону обратной эндотермической реакции, которая этот избыток энергии расходует. При уменьшении температуры, наоборот, равновесие смещается в сторону той реакции, которая идет с выделением тепла, чтобы оно компенсировало охлаждение, т.е. равновесие смещается в сторону прямой реакции.
При повышении температуры равновесие смещается в сторону эндотермической реакции, идущей с поглощением энергии.
При понижении температуры равновесие смещается в сторону экзотермической реакции, идущей с выделением энергии.
2) Влияние объема. При повышении давления в большей степени возрастает скорость реакции, протекающей с уменьшением объема (DV<0). При понижении давления ускоряется реакция, протекающая с увеличением объема (DV>0).
При протекании рассматриваемой реакции из 3 моль газообразных веществ образуется 2 моль газов:
2NO (Г) + O2 (Г)  2NO2 (Г)
2NO2 (Г)
3 моль газа 2 моль газа
VИСХ > VПРОД
DV = VПРОД - VИСХ <0
Поэтому при повышении давление равновесие смещается в сторону меньшего объема системы, т.е. продуктов реакции. При понижении давления смещение равновесия происходит в сторону исходных веществ, занимающих больший объем
При повышении давления равновесие смещается в сторону реакции, идущей с образованием меньшего количества молей газообразных веществ.
При понижении давления равновесие смещается в сторону реакции, идущей с образованием большего количества молей газообразных веществ.
3) Влияние концентрации. При повышении концентрации возрастает скорость реакции, по которой вводимое вещество расходуется. Действительно при внесении в систему дополнительного количества кислорода система «расходует» его на протекание прямой реакции. При понижении концентрации O2 этот недостаток компенсируется путем распада продукта реакции (NO2) на исходные вещества.
При повышении концентрации исходных веществ или понижении концентрации продуктов равновесие смещается в сторону прямой реакции.
При понижении концентрации исходных веществ или повышении концентрации продуктов равновесие смещается в сторону обратной реакции.
Введение катализатора в систему не влияет на смещение положения химического равновесия, поскольку катализатор одинаково увеличивает скорость как прямой, так и обратной реакции.
10. вопрос
Многие химические реакции протекают самопроизвольно, т.е. без затрат энергии извне. Одной из движущих сил самопроизвольного химического процесса является уменьшение энтальпии системы, т.е. экзотермический тепловой эффект реакции. Другой – стремление частиц (молекул, ионов, атомов) к хаотическому движению, беспорядку. Мерой хаотичности, неупорядоченности состояния системы служит термодинамическая функция, называемая энтропией (S).
При переходе системы из более упорядоченного состояния в менее упорядоченное состояние (нагревание, испарение, плавление) энтропия возрастает (DS>0). В случае перехода системы из менее упорядоченного состояния в более упорядоченное (охлаждение, конденсация, кристаллизация) энтропия системы уменьшается (DS<0).
В изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии (DS>0) – это суть второго закона термодинамики.
Энтропия вещества в стандартном состоянии называется стандартной энтропией (So) и имеет единицу измерения Дж/моль•К (Приложение, табл.1). Изменение энтропии системы в результате протекания химической реакции (DSo) равно сумме энтропий продуктов реакции за вычетом энтропий исходных веществ с учетом стехиометрических коэффициентов:
DSo = SSoпрод - SSoисх.
Энтропия вещества в газообразном состоянии существенно выше, чем в жидком и твердом состояниях, поэтому об изменении энтропии в химической реакции судят по изменению числа молей газообразных веществ. Например, в реакции
С(к) + СО2(г) = 2СО(г)
из одного моля СО2 образуется 2 моля СО, следовательно энтропия возрастает (DS>0).
В реакции образования аммиака
N2(г) + 3Н2(г) = 2NH3(г)
энтропия уменьшается, т.к. число молей NH3 меньше суммы молей N2 и Н2.
Возможность самопроизвольного протекания химического процесса определяется двумя факторами:
- стремлением к образованию прочных связей между частицами, к возникновению более сложных веществ, что сопровождается понижением энергии системы – энтальпийный фактор (DH<0);
- стремлением к разъединению частиц, к беспорядку, что характеризуется возрастанием энтропии – энтропийный фактор (DS>0).
Эти факторы объединяет функция, называемая энергией Гиббса (DG), равная:
DG = DH - T•DS.
Изменение энергии Гиббса служит критерием самопроизвольного протекания химической реакции:
- химическая реакция принципиально возможна, если энергия Гиббса в ходе реакции уменьшается (DG<0);
- химическая реакция не может протекать самопроизвольно, если энергия Гиббса системы возрастает (DG>0), протекает обратная реакция;
- химическая реакция может протекать как в прямом, так и в обратном направлении, т.е. система находится в состоянии равновесия (DG=0).
Из уравнения DG=DH-T•DS следует:
- если DН<0 и DS>0, то всегда DG<0, т.е. реакция с выделением теплоты и увеличением степени беспорядка возможна при любых температурах;
- если DH>0 и DS<0, то всегда DG>0, т.е. реакция с поглощением теплоты и увеличением степени порядка невозможна ни при каких условиях;
- DH>0, DS<0. Реакция будет протекать в прямом направлении только при условии, что |T•DS|>|DH|. Эти реакции протекают при высокой температуре;
- DH<0, DS>0. Условие самопроизвольного протекания реакции: |DH|>|T•DS|. Такие реакции идут обычно при низких температурах.
Температуру, при которой происходит смена знака энергии Гиббса реакции, можно определить из условия равновесия:
Тр = DH/DS,
где Тр – температура, при которой устанавливается равновесие.
Изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых в стандартных условиях, называется стандартной энергией Гиббса образования вещества (DGof). Стандартная энергия Гиббса образования простых веществ принимается равной нулю.
Стандартную энергию Гиббса химической реакции (DGor) можно рассчитать как сумму стандартных энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов:
DGo = SDGofпрод - SDGofисх.
Пример 1. На основании стандартных энтальпий образования и стандартных энтропий веществ вычислите DG реакции, протекающей по уравнению:
СО2(г) + 4Н2(г) = СН4(г) +2Н2О(ж).
В каком направлении будет протекать данная реакция? Рассчитайте температуру, при которой наступит равновесие.
Решение.
СО2(г) + 4Н2(г) = СН4(г) +2Н2О(ж).
DHof, кДж/моль -393,51 0 -74,85 -285,84
DSo, Дж/моль•К 213,6 130,6 186,19 69,96
n, моль 1 4 1 2
На основании следствия из закона Гесса вычисляем стандартные энтальпию и энтропию реакции:
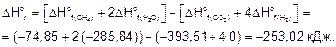
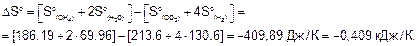
Стандартная энергия Гиббса
DGo = DHo - TDSo = -253,02-298(-0,409) = -131,14 кДж.
DGo<0, поэтому реакция протекает самопроизвольно при Т=298 К в прямом направлении.
Температура, при которой устанавливается равновесие:
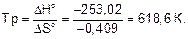
Ответ. Стандартная энергия Гиббса реакции -131,14 кДж, температура, при которой наступит равновесие 618,6 К.
Пример 2. Рассчитайте температуру, при которой становится возможным восстановление Fe2O3 углеродом по реакции:
Fe2O3(к) + 3С(к) = 2Fe(к) + 3СО(г).
Решение.
Fe2O3(к) + 2С(к) = 2Fe(к) + 3СО(г).
DHof, кДж/моль -821,32 0 0 -110,5
DSo, Дж/моль•К 89,96 5,74 27,15 197,4
n, моль 1 3 2 3
По следствию из закона Гесса вычисляем DHor и DSo реакции.
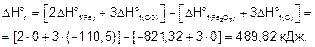
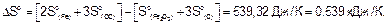
Стандартная энергия Гиббса
DGo = DHo - TDSo = 489,82 - 298•0,539 = 329,2 кДж.
DGo>0, следовательно реакция при Т=298 К невозможна.
Температура, при которой становится возможным восстановление Fe2O3
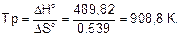
Ответ. Температура начала восстановления Fe2O3 908,8 К.
Пример 3. Возможна ли реакция разложения карбоната кальция СаСО3 при температурах 900 и 1200 К?
Решение. Уравнение реакции разложения СаСО3
СаСО3(к) = СаО(к) + СО2(г)
DHof, кДж/моль -1206,0 -635,1 -393,51
DSo, Дж/моль•К 92,9 39,7 213,6
n, моль 1 1 1
По следствию из закона Гесса вычисляем DHor и DSo реакции.
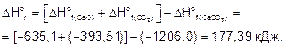
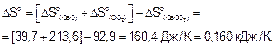
Энергия Гиббса при температурах 900 и 1200 К
DG900 = 177,39 - 900•0,160 = 33,39 кДж
DG900>0, следовательно реакция разложения СаСО3 при Т=900 К невозможна.
DG1200 = 177,39 - 1200•0,160 = -14,61 кДж
DG1200<0, следовательно при Т=1200 К реакция разложения СаСО3 протекает самопроизвольно.
Ответ. Разложение СаСО3 возможно при 1200 К (DG1200=-14,61 кДж) и невозможно при 900 К (DG900=33,39 кДж).
11.вопрос
ДИСПЕРСНЫЕ СИСТЕМЫ
Дисперсная система – это система из двух (или более) веществ, одно из которых (называемое дисперсной фазой) равномерно распределено в другом (называемом дисперсионной средой).
Различают несколько видов дисперсных систем в зависимости от степени дисперсности, т.е. величины, обратной среднему радиусу частиц дисперсной фазы: D=I/r. Радиус частиц выражается в нанометрах (нм). Наиболее грубыми дисперсными системами являются взвеси с размером частиц более 100 нм. Они представляют собой гетерогенные нестабильные во времени системы, в которых, однако, взвешенные частицы сохраняют все свойства фазы.
Микрогетерогенные системы с размером частиц 1…100нм представляют собой коллоидные растворы, занимающие промежуточное положение между взвесями и истинными растворами, т.е. гомогенными системами с размером частиц менее 1нм, неограниченно стабильными во времени. Истинные растворы определяют еще как многокомпонентные однофазные системы переменного состава, находящиеся в состоянии химического равновесия.
Для количественной характеристики растворов используют понятие концентрации:
Концентрация – величина, выражающая относительное содержание данного компонента в системе (смеси, растворе).
Из концентраций растворов наибольшее применение в химии находят следующие:
Процентная концентрация растворов показывает число единиц массы растворенного вещества, содержащееся в 100 единицах массы раствора, и для его приготовления следует взять 12 единиц массы СаСl2 и 88 единиц массы растворителя.
Молярная концентрация раствора (молярность) – отношение количества этого вещества, содержащегося в растворе (в молях), к объему раствора:
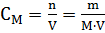 ,
,
где m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г∙моль-1; V – объем раствора, л. Единица Си – моль∙м-3, обычно применяют моль∙л-1.
Молярным называется раствор, в 1л которого содержится 1 моль растворенного вещества.
Эквивалентная (нормальная) концентрация раствора (нормальность) – отношение числа эквивалентов вещества, содержащегося в растворе, к объему раствора:
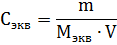
где m – масса растворенного вещества; Мэкв – молярная масса эквивалента растворенного вещества.
Единица эквивалентной концентрации в СИ – моль∙м-3, обычно применяют моль∙л-1.
Молярная концентрация раствора (моляльность) определяется числом молей растворенного вещества в 1кг (1000г) растворителя. Единица моляльности раствора в СИ – моль∙кг-1, можно применять моль∙г-1.
Основная особенность моляльного способа выражения концентрации заключается в том, что моляльная концентрация раствора не зависит от температуры, поскольку для определения моляльности не привлекается объем.
Массовой долей растворенного вещества называют отношение массы растворенного вещества к общей массе раствора. Массовую долю обычно выражают в долях единицы и обозначают W.
Мольная доля – отношение числа молей данного вещества в растворе к общему числу молей веществ, образующих раствор.
Для приготовления растворов заданных концентраций должны проводиться соответствующие расчеты.
Пример 1. Какой массы кристаллогидрат ВаCl2∙2H2O надо взять для приготовления раствора объемом 0,5л, в котором массовая доля ВаСl2 составляет 0,1 (10%-ный раствор)?
Решение. Если W(BaCl2) =0,1 или 10%, то плотность раствора р=1,090г∙см-3 (из справочных таблиц). Тогда масса раствора BaCl2 заданного объема равна 500∙1,090=545,0 (г). Масса BaCl2 в этом растворе находится из пропорции:
m(BaCl2) – m(р-ра BaCl2)
10 г – 100 г
х г – 545 г
х = 54,5г
Масса кристаллогидрата:
m(BaCl2∙2H2O) – m(BaCl2)
244,2г – 208,4г
х г – 54,5г
х = 64,0 г
Пример 2. Какова масса KCl, содержащегося в 0,5л раствора, если молярная концентрация раствора 0,2 моль∙л-1?
Решение. Молярную концентрацию (моль∙л-1) выражают формулой:
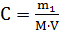 , где m1 – масса растворенного вещества, г; M – молярная масса растворенного вещества, г∙моль-1; V – объем раствора, л.
, где m1 – масса растворенного вещества, г; M – молярная масса растворенного вещества, г∙моль-1; V – объем раствора, л.
M(KCl) = 74,5г∙моль-1. Масса KCl, содержащегося в растворе, равна m1=M∙V∙C=0,2∙0,5∙74,5=7,45г.
Пример 3. Определите эквивалентную концентрацию хлорида железа (3), если в 0,3л раствора содержится 32,44г PeCl3.
Решение. Эквивалентная концентрация (нормальность раствора) рассчитывается по формуле:
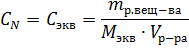
Молярная масса эквивалента PeCl3 равна:
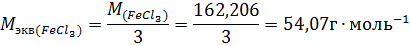
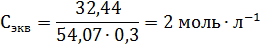
Пример 4. В какой массе воды надо растворить 5,85г хлорида натрия, чтобы получить раствор, моляльность которого равна 0,3моль∙г-1.
Решение. Моляльность раствора рассчитывается по формуле:
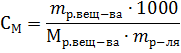
где mр-ля – масса растворителя в г. Отсюда:
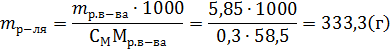
Пример 5.Вычисления, связанные с пересчетом концентраций растворов из одних единиц в другие.
Вычислите эквивалентную концентрацию, молярную концентрацию и моляльность раствора, в котором массовая доля СиSO4 равна 0,10. Плотность раствора 1107кг∙м-3.
Решение. Определим молярную массу и молярную массу эквивалента СиSO4.
M(СиSO4) = 160г∙моль-1; Мэкв(СиSO4) = 160/2=80г∙моль-1.
В 100 г раствора с ω(СиSO4)=0,1 содержится 10,0г СиSO4 и 90 г H2O. Следовательно, СМ раствора СиSO4 равна:
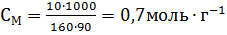 .
.
СМ и Сэкв относятся к 1 литру раствора: m=p∙V=1107∙10-3=1,107кг. В этой массе раствора содержится 1,107∙0,1=0,1107кг СиSO4, что составляет 110,7/159,61=0,693 моль или 0,693∙2=1,386экв.
Молярная концентрация и эквивалентная концентрация данного раствора соответственно равны 0,693 и 1,386моль∙л-1.
Пример 6. Расчеты, связанные с приготовлением разбавленных растворов из концентрированных.
Какой объем раствора азотной кислоты массовой долей HNO3 0,3(p=1180кг∙м-3) требуется для приготовления 20л 0,5 М раствора этой кислоты?
Решение. Сначала определяем массу азотной кислоты в 20л 0,5 М раствора:
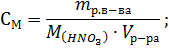
М(HNO3) = 63г∙моль-1; mр.в-ва = 0,5∙63∙20=630г.
Так как 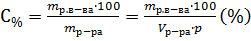 ; Следовательно для приготовления 20л 0,5 М раствора HNO3, надо израсходовать всего 1,78л раствора азотной кислоты 30%-й концентрации.
; Следовательно для приготовления 20л 0,5 М раствора HNO3, надо израсходовать всего 1,78л раствора азотной кислоты 30%-й концентрации.
Пример 7. Вычислите :а) массовую(процентную) (с,%); б) молярную концентрацию (см); молярную концентрацию эквивалента (сн); г) молярную (см) концентрацию раствора Н3РО4,полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031г/см3. Чему равен титр Т этого раствора?
Решение: а) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 282 см3 воды модно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г и, следовательно:
300 – 18
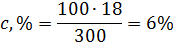
100 – с,%
б) молярная (мольно-объемная)% концентрация показывает число молей растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора 1031 г. Массу кислоты в литре раствора находим из соотношения
300 – 18
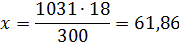
1031 – х
Молярную концентрацию раствора получим делением числа граммов Н3РО4 в 1 л раствора на молярную массу Н3РО4 (97,99 г/моль):
см = 61,86/97,99 = 0,63 М.
в) молярная концентрация эквивалента (или нормальность)
показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса Н3РО4 = М/ 3 = 97,99/3 = 32,66 г/моль, то
Cн = 61,86/32,66= 1,89 н.;
г) моляльная концентрация (или моляльность) показывает
число молей растворенного вещества, содержащихся в 1000 г
растворителя. Массу Н3РО4 в 1000 г растворителя находим из
соотношения
282 – 18
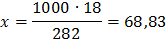
1000 – х
Отсюда см = 63,83/97,99 = 0,65 м.
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то Т=61,86/1000 = 0,06186 г/см3
Зная молярную концентрацию эквивалента и молярную массу эквивалента (тэ) растворенного вещества, титр легко найти по формуле
Т=снmэ/1000.
Пример 8.На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3' 0,5 н. раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной молярной концентрации эквивалентов реагируют в равных объемах. При разных молярных концентрациях эквивалентов объемы растворов реагирующих веществ обратно пропорциональны их норма-льностям, т.е.
V1:V2 =CH2 : СН1 или V1∙СН1 =V2∙CH2
50 СН1 = 25 ∙ 0,5 откуда CH1 = 25 ∙0,5 / 50 = 0,25н
Пример 9.К 1 л 10%-ного раствора КОН (пл. 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение. Масса одного литра 10%-ного раствора КОН равна 1092 г. В этом растворе содержится 1092 ∙10/100 = 109,2 г КОН. Масса 0,5 л 5%-ного раствора 1045 ∙ 0,5 = 522,5 г. В этом растворе содержится 522,5 ∙ 5/100 = 26,125г КОН.
В общем объеме полученного раствора (2 л) содержание КОН составляет 109,2 + 26,125 = 135,325 г. Отсюда молярная концентрация раствора Cм=135,325/(2 ∙ 56,1) = 1,2 М, где 56,1 г/моль — молярная масса КОН.
Пример 10.Какой объем 96%-ной серной кислоты плотностью 1,84 г/см3 потребуется для приготовления 3 л 0,4 н. раствора?
Решение. Эквивалентная масса H2SO4 = М/2 = 98,08/2 = 49,04 г/моль. Для приготовления 3 л 0,4 н. раствора требуется 49,04∙0,4∙3= = 58,848 г H2SO4. Масса 1 см3 96%-ной кислоты 1,84 г. В этом растворе содержится 1,84 ∙ 96/100 = 1,766 г H2SO4.
Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848 : 1,766 = 33,32 см3 этой кислоты.
12.вопрос
