Физические свойства аминокислот
Заряд аминокислот зависит от характера аминокислоты и рН среды:
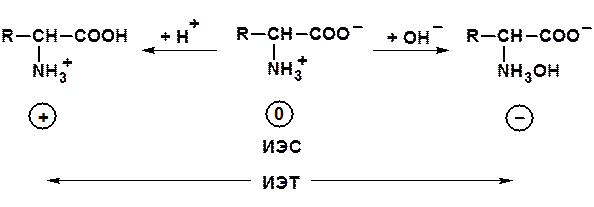
Химические свойства аминокислот
Реакционные центры
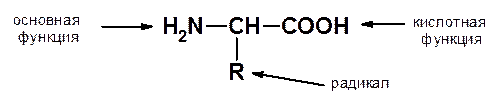
1. Дезаминирование:
1) восстановительное дезаминирование
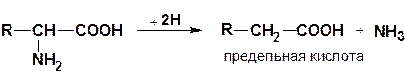
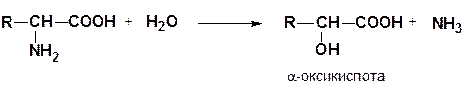
2) гидролитическое дезаминирование
3) внутримолекулярное дезаминирование
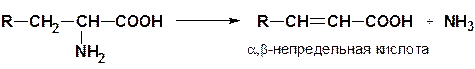
4) окислительное дезаминирование
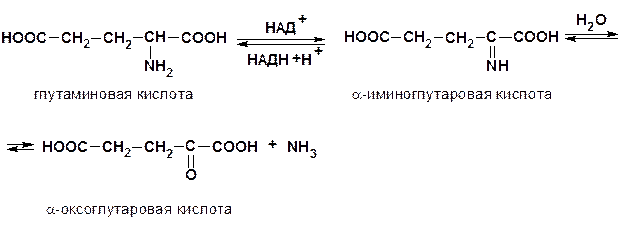
2. Декарбоксилирование
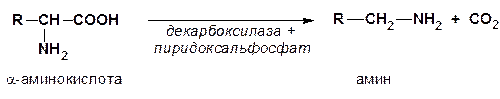
3. Образование эфиров
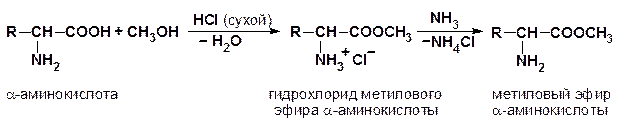
4. Образование галогенангидридов
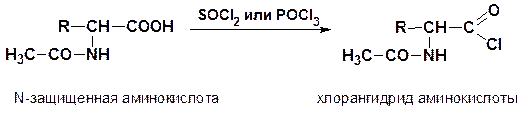
5. Образование N-ацильных производных
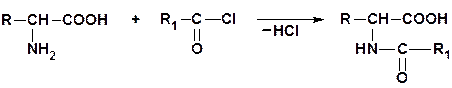
6. Образование оснований Шиффа (иминов)
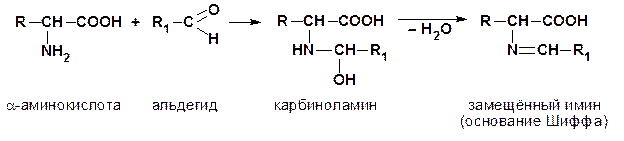
7. Трансаминирование

8. Альдольное расщепление
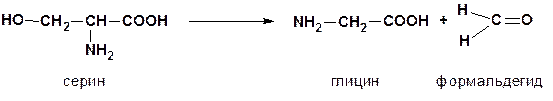
Обнаружение аминокислот
1. Нингидриновая реакция – универсальная реакция для всех аминокислот
а)окислительное дезаминирования аминокислоты и декарбоксилирование, образуется восстановленный нингидрин
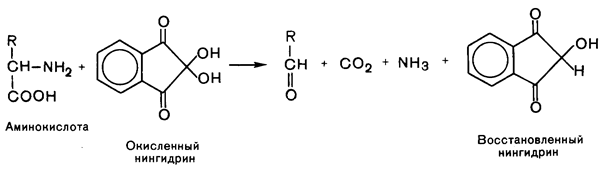
б) образовавшийся аммиак взаимодействует с эквивалентными количествами восстановленного и окисленного нингидрина, образуется продукт фиолетовой окраски
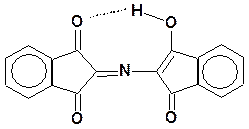
2. Ксантопротеиновая реакцияна ароматические аминокислоты (фен, тир, гис, три)
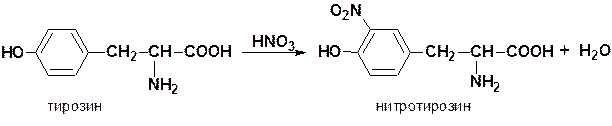
3. Реакция Миллона на тирозин
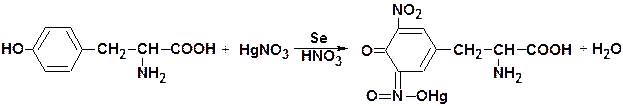
4. Реакция Фоляна аминокислоту цистеин, содержащую слабосвязанную серу.
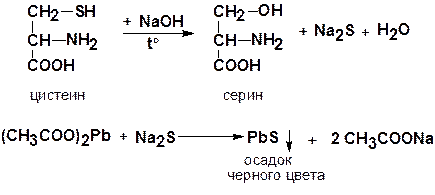
5. Реакция Сакагучина аргинин
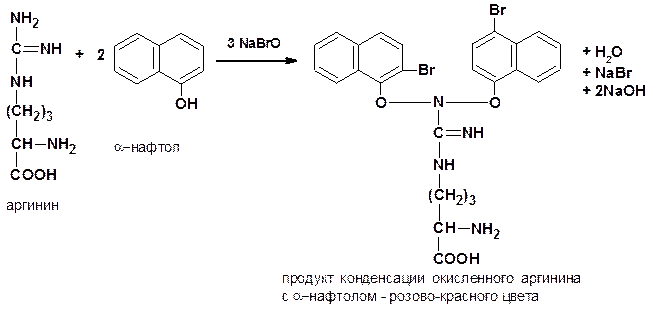
Синтез аминокислот
1. В организме (in vivo)
а) восстановительное аминирование α-кетокислот
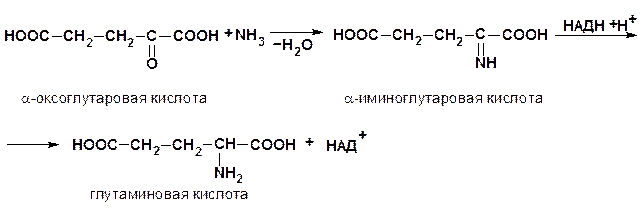
б) трансаминирование
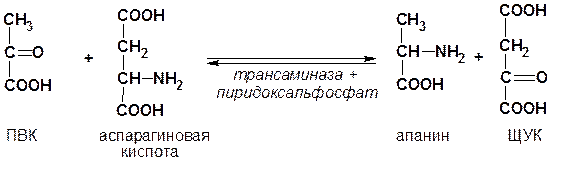
2. Вне организма (in vitro)
а) синтез Штреккера-Зелинского
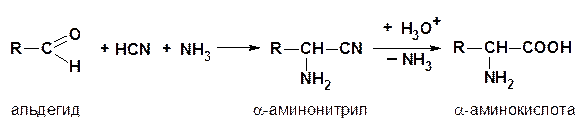
б) аммонолиз галогенокислот
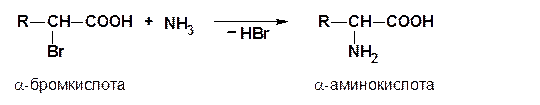
ПЕПТИДЫ
Пептиды построены из остатков аминокислот, соединенных пептидной –СО–NH– связью.
Строение пептидной связи
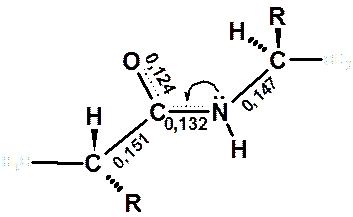
Пептидная связь обладает цис- и трансформой относительно a-углеродных атомов, расположенных по обе стороны от этой связи.
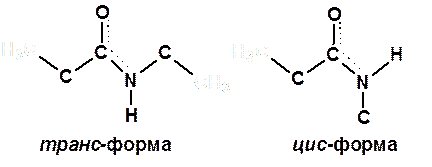
Трансформа более предпочтительна, т.к. стерически она менее затруднена R-группами, чем цис-форма.
Пептиды образуются либо при распаде белков, либо в реакции поликонденсации α–аминокислот.
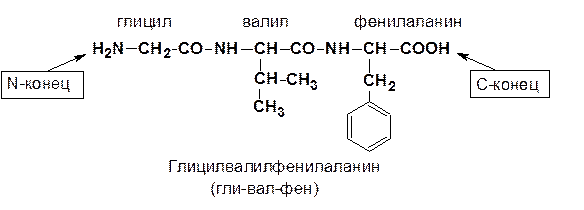
БЕЛКИ
Классификации белков
1. Химическая

2. Биологическая

Ценность белка определяется:
1) содержанием незаменимых аминокислот
2) степенью усваиваемости организмом.
Уровни структурной организации белка
Первичная –последовательность соединения аминокислот в бел-
ковой цепи (линейная).
Связи ковалентные:
–СО–NH– пептидная (основная)
–S–S– дисульфидная (вспомогательная).
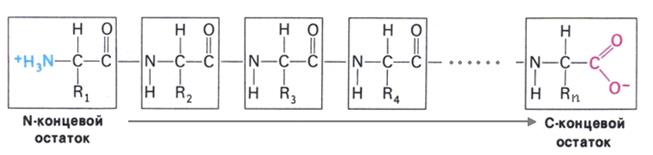
Вторичная –способ укладки полипептидной цепи (двухмерная).
Связь водородная
(α-спираль – внутримолекулярная,
β-структура – межмолекулярная).
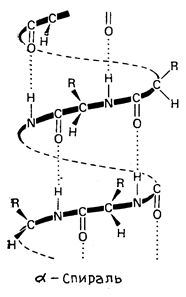
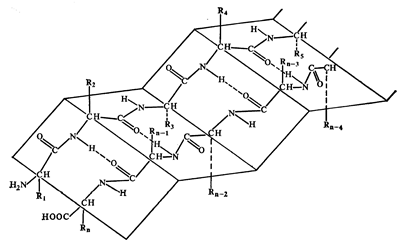
α-спираль β-структура
Рис. 13. Вторичная структура белков
Третичная –способ укладки пролипептидной цепи в пространст-
ве (трёхмерная).
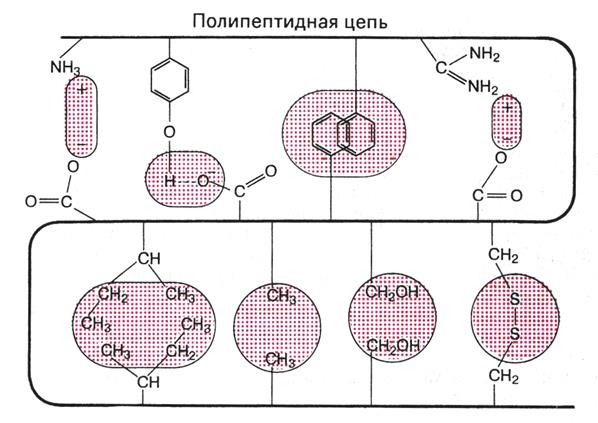
Связи: ковалентные –S–S– , водородные, гидрофобные, ионные, диполь-дипольные взаимодействия.
 |  | ||




| ||||||
|
| |||||
Рис. 14. Связи, стабилизирующие третичную структуру белков
четвертичная –способ укладки в пространстве отдельных субъединиц, имеющих собственную первичную, вторичную и третичную структуры. При этом формируется единое в структурном и функциональном отношении образование.
Связи: гидрофобные взаимодействия, водородные и ионные связи.
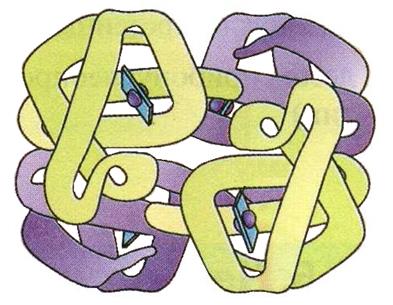
Рис. 15. Четвертичная структура гемоглобина
