Научиться определять направление протекания окислительно-восстановительных процессов по окислительно-восстановительным потенциалам реагирующих веществ
I. Теоретическая часть:
1)Определение понятия химических источников тока.
Гальванический элемент- это система, состоящая из двух электродов в растворы электролитов, в которой за счет протекания ОВР возникает электрический ток, т.е. наблюдается превращение химической энергии в электрическую. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуется в процессе его работы. После расхода реагентов элемент не может больше работать. Таким образом, этот источник тока одноразового действия, поэтому его ещё называют первичным химическим источником тока.
2) Двойной электрический слой на границе раздела металл-раствор.
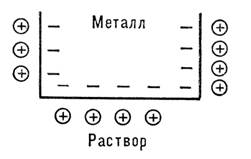 При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной реакцией является взаимодействие поверхностных ион-атомов металла, находящихся в узлах решётки, с полярными молекулами воды, ориентированными у поверхности электрода. В результате взаимодействия происходит окисление металла и его гидротированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле. Металл становиться заряжен отрицательно, а раствор положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл-раствор возникает двойной электрический слой.
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной реакцией является взаимодействие поверхностных ион-атомов металла, находящихся в узлах решётки, с полярными молекулами воды, ориентированными у поверхности электрода. В результате взаимодействия происходит окисление металла и его гидротированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле. Металл становиться заряжен отрицательно, а раствор положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл-раствор возникает двойной электрический слой.
3)Уравнения Нернста.
Зависимость электродного потенциала от концентраций веществ, участвующих в электродных процессах, и от температуры выражается уравнением Нернста:
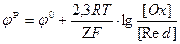 ,где
,где 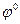 - стандартный электродный потенциал;
- стандартный электродный потенциал;
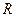 -газовая постоянная;
-газовая постоянная;
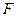 -постоянная Фарадея(96500 Кл/моль);
-постоянная Фарадея(96500 Кл/моль);
Z -число электронов, участвующих в электродном процессе.
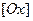 и
и 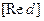 - произведения концентраций (активностей) веществ, принимающих участие в соответствующей полуреакций в окисленной
- произведения концентраций (активностей) веществ, принимающих участие в соответствующей полуреакций в окисленной 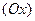 и восстановленной
и восстановленной 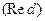 формах.
формах.
После подстановки, а уравнение значений 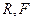 и
и 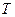 приобретает для
приобретает для 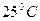 (298 K) следующий вид:
(298 K) следующий вид:
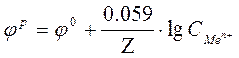 ,где
,где 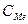 -молярная концентрация металла.
-молярная концентрация металла.
4)Определение понятия анода и катода.
Электрод с меньшим значением 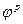 ( равновесного потенциала) называется анодом. На аноде происходит окисление.
( равновесного потенциала) называется анодом. На аноде происходит окисление.
Электрод с большим значением 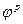 ( равновесного потенциала) называется катодом. На катоде восстанавливаются ионы металла из раствора электролита.
( равновесного потенциала) называется катодом. На катоде восстанавливаются ионы металла из раствора электролита.
5)Вычисление ЭДС химических источников тока.
ЭДС – это максимальная разность потенциалов между электродами, которая достигается при работе гальванического элемента:
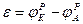 >0
>0
II Экспериментальная часть:
Опыт 1.
Тема: «Составление медно-цинкового гальванического элемента».
Задание: сравнить значение теоретической ЭДС с экспериментальным значением.
Результаты опыта:
Значение ЭДС гальванического элемента, определенное экспериментально составляет 0,5В.
Вычислим теоретическое значение ЭДС. Для этого:
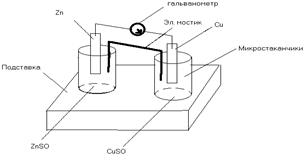 |
1.Составим схему собранного элемента гальванического.(Даниэля-Якоби)
