Механизм действия ферментов. Механизм действия ферментов-протеидов и ферментов-протеинов однотипен и заключается в том, что ферменты ускоряют биохимическую реакцию за счет понижения ее
Механизм действия ферментов-протеидов и ферментов-протеинов однотипен и заключается в том, что ферменты ускоряют биохимическую реакцию за счет понижения ее энергии активации (рис 15).
По современным представлениям в ходе ферментативной реакции выделяют ряд этапов:
1) диффузия молекулы субстрата к ферменту и стерическое связывание его с активным центром фермента;
2) преобразование первичного промежуточного комплекса в один или более активированный фермент;
3) отделение конечных продуктов реакции от фермента и диффузия их в окружающую среду.
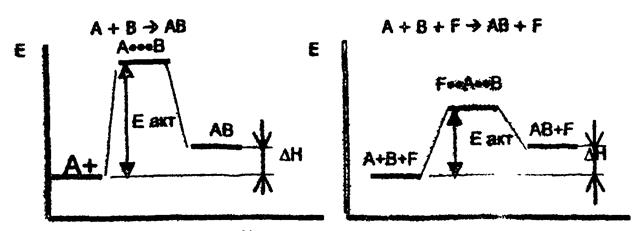
| Ход реакции | Ход реакции |
| а) | б) |
Рис.15. Схемы реакций анаболизма (синтеза сложных молекул из более простых): а - реакция без участия фермента; б - реакция с участием фермента С - энергия; А···В - промежуточный комплекс; F···А···В - активированный фермет-субстратный комплекс; ΔН - тепловой эффект реакции, не зависит от участия катализатора
Как видно из представленных схем, введение в химическую систему фермента способствует значительному понижению энергии активации реакции и тем самым обусловливает возрастание скорости реакции.
Для реакции катаболизма (расщепление сложных молекул на простые компоненты): АВ → А + В можно составить следующие схемы:
a)AB + F → ABF;
б) ABF→ А + BF; (а+б+в): АВ + F → ABF → А + В + F.
в) BF → В + F;
Свойства ферментов
Ферменты, как и неферментные катализаторы, характеризуются следующими сходными свойствами:
1. Они остаются неизменными после реакции и могут вновь реагировать с новыми молекулами субстрата (хотя активность их может измениться под влиянием условий среды) до тех пор, пока по каким-либо причинам не разрушатся.
2. Они оказывают свое действие в ничтожно малых концентрациях.
3.Они лишь повышают скорость реакции и не оказывают влияния на величину константы равновесия.
4. Они катализируют только энергетически возможные реакции.
Однако ферменты, являясь белками, имеют следующий ряд свойств, отличающийся от свойств небиологических катализаторов.
1. Ферменты "работают" в очень мягких условиях (низкая температура – температура тела, нормальное давление, близкое к нейтральному значению рН). Будучи белками, они очень чувствительны к сдвигам рН и к изменениям температуры, т.е. термолабильны.
2. Скорость ферментного катализа гораздо выше, чем небиологического, т.е. ферменты сильнее снижают энергию активации реакции, чем другие катализаторы, Так, например, гидролиз белка до аминокислот под действием неорганических катализаторов (кислот или щелочей) осуществляется при температуре 100° С и выше за несколько десятков часов. Этот же процесс при каталитическом участии ферментов (например, пепсина или трипсина) требует всего десятков минут и идет при температуре 30-40 °С. Другой пример: в организме человека ежесуточно распадается около 0,5 кг глюкозы до СО2 и Н2О; в отсутствии биокатализаторов для этого потребовалось бы примерно 10000 лет. Благодаря каталитическому действию ферментов, в живой природе с большей скоростью происходят реакции, выполнение которых в лабораторных условиях остается пока еще невозможным.
3. Ферменты обладают высокой специфичностью,что позволяет ферментам направлять обмен веществ в определенное русло.
4. В отличие от небиологических катализаторов активность ферментов можно регулировать. Это уникальное свойство ферментов позволяет изменять скорость превращения веществ в организме в зависимости от условий среды, т.е. приспосабливаться к действию различных факторов.
5. Скорость ферментативной реакции в отличие от небиологического катализа прямо пропорциональна концентрации катализатора-фермента.
Остановимся на некоторых свойствах ферментов более подробно.
