Способы выражения их концентрации
Введём условные обозначения: А – растворитель, В – растворённое вещество.
1.Массовая доля растворенного вещества–отношение массы растворенного вещества m(В) к общей массе раствора m(раствора):
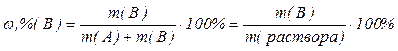 .
.
Например: 20% раствор Na2SO4 содержит 20 г Na2SO4 и 80 г H2O.
2. Молярная концентрация (молярность) – число моль растворенного вещества n(В), содержащихся в 1 литре раствора:
СМ(В)= 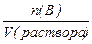 [моль/м3 или моль/л],
[моль/м3 или моль/л],
где V(pаствора) – объём раствора, м3 или л.
Например: 1М раствор H2SO4 содержит в каждом литре 1 моль Н2SO4 или 98 г серной кислоты.
3. Молярная концентрация эквивалентов – число моль эквивалентов растворенного вещества nэ(В), содержащихся в 1 литре раствора:
Сэ(В) = nэ(В)/V(р-ра) [моль/м3 или моль/л]
Например:раствор H2SO4 Сэ = 1 моль/л содержит в каждом литре 1 моль эквивалентов Н2SO4 или 49 г Н2SO4.
4. Моляльная концентрация (моляльность) – число моль растворенного вещества n(В), содержащихся в 1кг растворителя ( 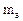 = 1кг = 1000г):
= 1кг = 1000г):
Сm(В) = 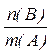 [моль/кг или моль/1000 г]
[моль/кг или моль/1000 г]
Например: 1m водный раствор H2SO4 содержит в каждом килограмме воды 1моль Н2SO4 (или 98 г Н2SO4). Этот способ выражения концентрации широко применяется в теории растворов, особенно растворов электролитов, ввиду его независимости от температуры и возможности приготовления растворов с высокой точностью выражения концентрации.
5. Молярная доля – отношение числа молей растворенного вещества n(В) (или растворителя n(A)) к общему количеству моль компонентов раствора
n(В) + n(A):
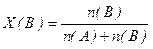 ,
, 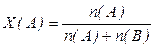 ,
, 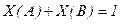 .
.
Например: водный раствор H2SO4 с молярной долей 0,2 содержит на 1 моль Н2SO4 - 4 моль H2O.
По концентрации растворенного вещества растворы можно подразделить на:
-концентрированные(с большой концентрацией растворенного вещества);
-разбавленные (с малой концентрацией растворенного вещества).
Пример 30.Вычислите: а) массовую долю (ω, %); б) молярность (См); в) моляльность (Сm); H3PO4 в растворе, полученном при растворении 18 г H3PO4 в 282 см3 воды, если относительная плотность полученного раствора составляет 1,031 г/см3.
Дано:
m(H3PO4) = 18 г; V(H2O) = 282 см3; m(H2O) = 282 г; ρ(р-ра) = 1,031 г/см3.
Найти:
ω, %, См, Сm –?
Решение:
а)массовая доля растворенного вещества (ω) показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Тогда масса полученного раствора будет
m(р-ра) = 18 + 282 = 300 (г)
Из формулы:
ω(В) = (m(В)/ m(р-ра))•100%
ω = (18/300) •100 = 6 %;
б) молярность (См), показывает число моль растворенного вещества, содержащихся в 1 дм3 раствора.
Масса 1 дм3 раствора 1031 г. Масса кислоты в 1 дм3 раствора составит:
х = 1031•18/300 = 61,86 (г)
Молярность раствора получим делением массы m(H3PO4)в 1 дм3 раствора на молярную массу H3PO4.  М (H3PO4) = 98 г/моль:
М (H3PO4) = 98 г/моль:
См(В) = 61,86/98= 0,63 моль/дм3
в) моляльность (Cm) показывает число моль растворенного вещества, содержащихся в 1000 г растворителя.
Cm (В) = (m(В)•1000)/(М(В)•m(р-ля))
Следовательно:
Cm =(18•1000)/(98•282)=0,65 моль/кг
Ответ: ω(В) = 6 %; См(В) = 0,63 моль/дм3; Cm (В) = 0,65 моль/кг.
Растворы неэлектролитов
Неэлектролитами являются вещества, которые не способны проводить электрический ток в растворах или расплавах.
