Способы выражения концентрации растворов
Концентрация раствораопределяется массой или количеством растворенного вещества, содержащегося в определенном объеме или массе раствора (растворителя).
Массовая доля растворенного вещества (ω)равна отношению массы растворенного вещества к массе раствора. Массовая доля – это безразмерная величина, ее выражают в долях единицы или в процентах.
ω = 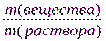 ∙
∙ 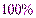
Для расчета массы раствора могут использоваться формулы:
m(раствора) = m(вещества) + m(растворителя)
m(раствора) = Vраствора · ρраствора
Молярная концентрация растворенного вещества (С)равна отношению количества вещества (νраств. вещ.) к объему раствора (V), единица измерения – моль/л.
C = ν / V = 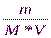

Задание 1. Определите молярную концентрацию раствора бромида натрия, если массовая доля соли в этом растворе равна 10%, а плотность раствора 1,1 г/мл.
Дано:
ω = 10% = 0,1
ρ = 1,1 г/мл
Vр-ра = 1 л
Найти
С -?
Решение.
Объем раствора равный 1 л выбран произвольно, так как характеристика раствора (плотность,
концентрация) не зависят от величины выбранного образца.
1) mр-ра = V· ρ = 1000 мл · 1,1 г/мл = 1100 г
2) mв-ва = ω · mр-ра = 0,1 · 1100 г = 110 г
3) M(NaBr) = 103 г/моль
4) ν(NaBr) = mв-ва / М = 110 г : 103 г/моль = 1,07 моль
5) С = ν / V = 1,07 моль / 1 л = 1,07 моль/л
Ответ: С = 1,07 моль/л\
Электролиты– это вещества, растворы или расплавы которых проводят электрический ток. Это, как правило, соли, кислоты, щелочи, т.е. вещества ионного строения.
Электролитическая диссоциация - это процесс распада электролитов на ионы под действием полярных молекул растворителя (чаще всего воды).
Кислоты– электролиты, при диссоциации которых образуются катионы водорода Н+.
HNO3 = H+ + NO3-
Щелочи – электролиты, при диссоциации которых образуются гидроксид – анионы ОН-
NaOH = Na+ + OH-
Соли –электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Na2SO4 = 2 Na+ + SO42-
Кислые соли -хорошо растворимые электролиты, они диссоциируют ступенчато (аналогично многоосновным кислотам)
Ca(HSO4 )2= Ca2+ + 2HSO4-HSO4- = H+ + SO42-
Основные соли – малорастворимые вещества. Эти электролиты диссоциируют только по первой ступени.
ВaOHNO3 = BaOH+ + NO3-
При составлении уравнений ионного обмена (реакции, протекающие между растворами веществ) следует учитывать, что сильные электролиты в растворе присутствуют в виде ионов, а не молекулярных или ионных соединений. Сильные электролиты в ионно-молекулярных уравнениях записываются в виде ионов, а слабые электролиты – в виде молекул
Сильные электролиты:
- растворимые соли
- кислоты HClO4, H2SO4, HNO3, HMnO4, H2CrO4, HCl, HBr, HI
- растворимые в воде основания щелочных и щелочноземельных металлов (Са(ОН)2 хотя и малорастворимое соединение)
Задание 2. Составить ионно - молекулярное уравнение взаимодействия раствора хлорида меди (II) с раствором сероводородной кислоты.
CuCl2 + H2S = CuS + 2 HCl
Соль СuCl2 растворима в воде, это сильный электролит, записываем ее в виде ионов.
Кислота H2S– слабый электролит, следовательно, запишем ее в виде молекулы.
CuS – нерастворимая соль (осадок), запишем в виде молекулы.
HCl – сильная кислота, запишем в виде ионов.
Составим полное ионно-молекулярное уравнение.
Cu2+ + 2 Cl - + H2S = CuS ↓ + 2H+ + 2 Cl -
Так как ионы хлора в ходе реакции не изменились (по 2 иона в левой и в правой части уравнения), их можно как участников химического превращения не рассматривать (сократить). Составим сокращенное ионно-молекулярное равнение.
Cu2+ + H2S = CuS ↓ + 2 H+
Реакции ионного обмена протекают до конца (реакции практически осуществимы), если выполняется хотя бы одно из условий: образование осадка, выделение газа, образование слабого электролита (например, воды). Другими словами, одно из веществ должно быть выведено из среды раствора.
Задание 3. Осуществите превращение по схемам:
а) FeCl3 à Fe(OH)3 б) Na2SO4 à NaCl
а) В данном случае исходное вещество растворимо в воде (сильный электролит), а продукт реакции – нерастворимое вещество. При этом условии уже учтено выполнения одного из условий протекания реакции обмена до конца. Единственная задача – подобрать правильно второе исходное вещество. Оно должно содержать гидроксид-ион ОН-, второе условие – вещество должно быть растворимым. Следовательно, к FeCl3необходимо прибавить раствор щелочи (NaOH, KOH, Ba(OH)2 и т.д.)
FeCl3 + 3 NaOH = Fe(OH)3 ↓ + 3 NaCl
Fe3+ + 3 OH- = Fe(OH)3 ↓
б) Оба вещества, исходное и полученное, растворимы в воде. Следовательно, при подборе реагента необходимо учитывать следующие требования: вещество должно быть растворимо в воде (соли реагируют по реакциям обмена с растворимыми кислотами, основаниями, солями); второй продукт реакции должен образоваться в виде осадка, газообразного вещества или воды, иначе реакция не пройдет до конца, т.е. не будет практически осуществимой.
По условию в виде осадка придется получать вещество, содержащие анионы SO42-, это могут быть BaSO4, PbSO4, CaSO4, Ag2SO4. Следовательно, в левую часть уравнения необходимо ввести растворимое соединение, содержащие катионы Ba2+, Pb2+, Ca2+, Ag+ и анионы Сl-. Соединения AgClи PbCl2 не растворимы. Можно в качестве реагента использовать соли BaCl2или СaCl2.
Na2SO4 + BaCl2 = 2 NaCl + BaSO4 ↓
SO42- + Ba2+ = BaSO4 ↓
