Номенклатура гетероциклических соединений
Аминопроизводные нафталина
И -нафтиламины
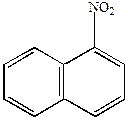 | 6H  | 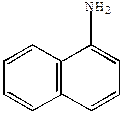 |
 -нитронафталин -нитронафталин |  -нафтиламин -нафтиламин |
 | NH3  | 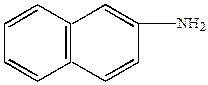 |
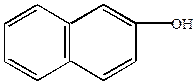
 -нафтол -нафтол |  -нафтиламин -нафтиламин |
Обладают свойствами первичных ароматических аминов, легко окисляются (применяются как антиоксиданты), например,
Неозон Д (фенил- 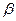 -нафтиламин) – антиоксидант для резин.
-нафтиламин) – антиоксидант для резин.
Первичные аминопроизводные нафталина диазотируются с образованием солей диазония и используются для получения красителей.
Гетероциклические соединения
Соединения с замкнутым строением цепи, в состав которой наряду с углеродом входят гетероатомы (N, O, S и другие атомы).
Классификация
| Предельные гетероциклические соединения, содержащие только простые связи в цикле | Непредельные гетероциклические соединения, содержащие изолированные кратные связи и проявляющие явный ненасыщенный характер | Ароматические гетероциклические соединения, содержащие две или более кратных связей, находящихся в сопряжении с гетероатомом, образуя ароматический секстет 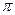 (р)-электронов. (р)-электронов. |
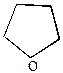 ТГФ ТГФ | 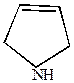 пирролин пирролин | |
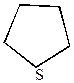 тиофан тиофан | ||
 пиперидин пиперидин |
1 и 2 группы по свойствам мало отличаются от простых эфиров, аминов и сульфидов открытого строения, поэтому отдельно рассматриваться не будут.
Ароматические гетероциклические соединения
Классифицируются по:
1) величине кольца (пятичленные, шестичленные гетероциклы и т.д.);
2) количеству колец (моноциклические, полициклические);
3) типом гетероатомов (азотсодержащие, кислородсодержащие, серосодержащие и др.).
Ароматические моноциклические пятичленные гетероциклы
Наиболее важные:
| Ряд фурана | Ряд пиррола | Ряд тиофена |
 | 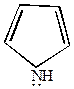 | 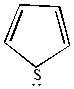 |
| Фрагмент фурфурола ТГФС | Входит в состав гемоглобина и хлорофилла | Для получения фармацевтических препаратов |
Каждое из этих соединений по составу является ненасыщенным, однако, в химических превращениях они ведут себя подобно ароматическим соединениям: 1) труднее окисляются по сравнению с ненасыщенными; 2) дают лишь немногие реакции присоединения (с галогенами, H2SO4, HNO3); 3) легко вступают в реакции электрофильного замещения. Объясняется это тем, что гетероатомы (O, S, N) имеют на внешней электронной оболочке неподеленные пары р-электронов, одна из которых вступает во взаимодействие с 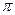 -электронами сопряженных двойных связей кольца, что приводит к образованию секстета и к выравниванию электронной плотности на кольце и увеличению ее по сравнению с бензольным кольцом.
-электронами сопряженных двойных связей кольца, что приводит к образованию секстета и к выравниванию электронной плотности на кольце и увеличению ее по сравнению с бензольным кольцом.
На примере пиррола это выглядит следующим образом:
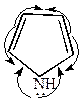 | 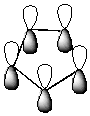 |
4 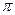 +2p=6 электронов. Кольцо плоское, т.е. выполняются правила Хюккеля.
+2p=6 электронов. Кольцо плоское, т.е. выполняются правила Хюккеля.
Номенклатура гетероциклических соединений
Рациональная – за основу берется простейший член ряда. Положение заместителя указывается буквами греческого алфавита или цифрами (нумерация от гетероатома в сторону ближайшего заместителя). Например,
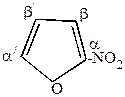 | 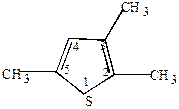 |
 -нитрофуран -нитрофуран | 2,3,5-триметилтиофен |
Способы получения
Основаны на процессах циклизации соединений открытого строения.
1) Синтезы на основе  -дикарбонильных соединений
-дикарбонильных соединений
а) нагревание в присутствии водоотнимающих средств (H2SO4, ZnCl2)
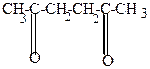 | H+  | 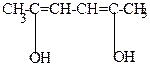 | t  -H2O -H2O | 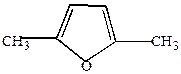 |
| ацетонилацетон | в енольной форме | 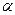 , , 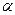 /-диметилфуран /-диметилфуран |
б) нагревание в присутствии NH3.
 | +NH3  -2H2O -2H2O |  |
| ацетонилацетон в енольной форме | 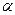 , , 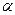 /-диметилпиррол /-диметилпиррол |
2) Синтезы на основе ацетилена и других углеводородов.
а) конденсация ацетилена с S, H2S или FeS2 (железный колчедан)
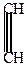 | + | 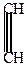 | t + FeS2  |  | +FeS |
| железный колчедан |
б) конденсация ацетилена с аммиаком
 | + |  | через раскаленные трубки  |  | +H2 |
| NH3 | пиррол |
3) Синтезы на основе полиоксисоединений природного происхождения.
4) Сухая перегонка слизевой кислоты (получается окислением лактоз)
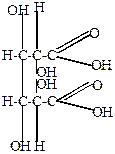 | t  CO2 + 3H2O + CO2 + 3H2O + | 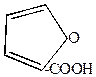 | +CaO  -CaCO3 -CaCO3 | 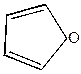 |
| пирослизевая кислота | фуран |
5) Реакция Юрьева
Позволяет осуществить взаимопревращение пятичленных гетероциклов на катализаторе (Al2O3) при температуре 4500С и действии H2O, H2S, NH3.
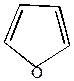 | +H2S   +H2O +H2O |  |
NH3  H2O H2O  | NH3  H2S H2S 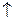 | |
 |
Физические свойства
Бесцветные жидкости с запахом хлороформа, бензола. В воде почти нерастворимы. Очень различны по температурам кипения.
| Ткип, 0С | М | |
| Фуран | ||
| Тиофен | ||
| Пиррол |
Аномально высокая температура кипения пиррола объясняется наличием водородных связей.
Химические свойства
Подразделяются на:
I. Свойства, в которых проявляется ароматический характер кольца.
II. Реакции, в которых проявляется ненасыщенный характер кольца.
III. Кислотно-основные свойства, обусловленные наличием гетероатомов.
Соотношение этих свойств связано с тем, насколько равномерно распределена электронная плотность в ядре гетероцикла. Все гетероатомы (кислород, азот, сера) обладают более высокой электроотрицательностью, чем углерод, и поэтому притягивают к себе электроны соседних связей, сообщая соединению дипольный момент, направленный к гетероатому.
У насыщенных (полностью гидрированных) гетероциклов дипольный момент направлен к гетероатому, например,
| тетрагидрофуран | пирролидин | Тиофан |
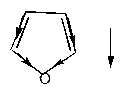 | 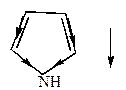 | 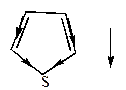 |
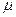 =1,68Д =1,68Д | 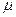 =1,57Д =1,57Д | 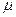 =1,87Д =1,87Д |
У ароматических гетероциклов наблюдается уменьшение дипольных моментов и даже (в случае пиррола) изменение его направления.
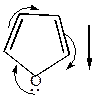 | 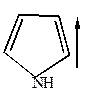 |  |
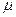 =1,70Д =1,70Д | 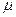 =1,80Д =1,80Д | 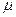 =1,52Д =1,52Д |
Это вызвано наличием сопряжения неподеленных пар электронов гетероатомов с 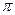 -электронами кольца, вследствие чего р-электроны гетероатомов оттягиваются на кольцо. Происходит делокализация электронной плотности, приводящая к появлению ароматических свойств, что видно из величин энергии сопряжения (делокализации)
-электронами кольца, вследствие чего р-электроны гетероатомов оттягиваются на кольцо. Происходит делокализация электронной плотности, приводящая к появлению ароматических свойств, что видно из величин энергии сопряжения (делокализации)
| фуран | пиррол | тиофен | Бензол | |
 Е, кДж/моль Е, кДж/моль | 92,4 | 109,2 | 130,2 | 150,0 |
а также данных о длинах связей (в нм)
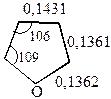 | 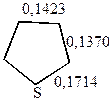 | 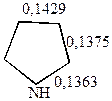 |
т.е. наиболее высокой степенью ароматичности обладает тиофен, у которого энергия делокализации лишь на 10% меньше, чем у бензола.
В целом распределение электронной плотности в кольцах гетероциклов не вполне равномерное. Наиболее высокая плотность электронных зарядов во всех трех гетероциклах наблюдается в положении 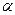 .
.
Рассмотрим, как эти закономерности проявляются в конкретных реакциях.
I. Реакции, обусловленные ароматическим характером кольца.
1) Реакции электрофильного замещения.
Чрезвычайно легко идут у фурана и пиррола. Тиофен менее реакционноспособен, чем пиррол и фуран, но более активен, чем бензол, он вступает в реакцию электрофильного замещения в 1000 раз быстрее, чем бензол.
Активность ароматических пятичленных гетероциклов в реакциях электрофильного замещения больше, чем у бензола, т.к. у бензола на 6 С-Н связей приходится 6 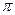 -электронов, а у пятичленных гетероциклов на 4 С-Н связи - 4
-электронов, а у пятичленных гетероциклов на 4 С-Н связи - 4 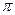 +2р-электрона, вследствие чего электронная плотность у каждого атома углерода больше. Кроме того,
+2р-электрона, вследствие чего электронная плотность у каждого атома углерода больше. Кроме того, 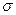 -комплекс дополнительно стабилизируется за счет образования ониевых структур атомами О и N.
-комплекс дополнительно стабилизируется за счет образования ониевых структур атомами О и N.
Если электрофильный реагент Е+ присоединяется в 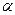 -положение, то
-положение, то
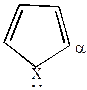 | +Е+  | 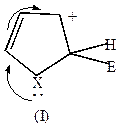 | 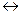 | 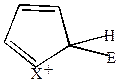 |
Если электрофильный реагент Е+ присоединяется в  -положение, то
-положение, то
 | +Е+  | 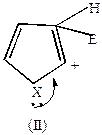 | 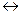 | 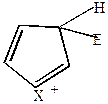 |
Комплекс (I) более устойчив, чем комплекс (II), т.к. делокализация положительного заряда в случае (I) идет по 4-м атомам, а в случае (II) – только по 2-м (поэтому замещение идет преимущественно в положение  ).
).
 Пиррол фуран тиофен бензол
Пиррол фуран тиофен бензол
увеличивается активность в реакциях электрофильного замещения
Следует отметить особый подбор реагентов для реакций электрофильного замещения в пятичленных гетероциклах, связанный с тем, что фуран и пиррол проявляют явную ненасыщенность. Азотная кислота, серная кислота, хлор вызывают реакции полимеризации диенов (“осмоление”), поэтому применяют более мягкие агенты.
А. Галоидирование
1. Хлорирование свободным хлором возможно лишь для тиофена, при этом образуется смесь моно- и полихлорпроизводных.
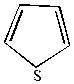 | +Cl2  -HCl -HCl | 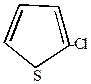 | +Cl2  -HCl -HCl | 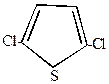 | +Cl2  … -HCl … -HCl |
.
2. Монохлорирование пиррола осуществляется действием хлористого сульфурила (хлоран4гидрида серной кислоты)
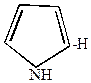 | +SO2Cl2  | 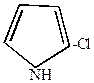 | +SO2 + HCl |
 -хлорпиррол -хлорпиррол |
3. Монобромирование фурана можно провести под действием диоксандибромида.
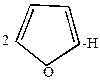 | + |  |  2 2 | 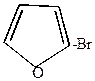 | + | 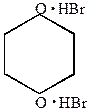 |
 -бромфуран -бромфуран | диоксандигидробромид |
В. Сульфирование
1. Тиофен сульфируется концентрированной H2SO4 уже при комнатной температуре
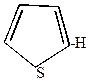 | комн. + HOSO2OH  | 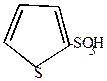 | + H2O |
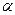 -сульфотиофен -сульфотиофен |
2. Фуран и пиррол сульфируются под действием пиридинсульфотриоксида.
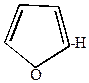 | + |  |  | 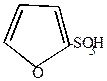 | + |  |
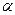 -сульфофуран -сульфофуран | пиридин |
С. Нитрование
Нитрование фурана и пиррола осуществляется действием концентрированной HNO3 в уксусном ангидриде.
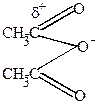 | + HO-NO2  | 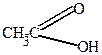 | ||
| + | ||||
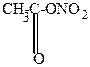 | ||||
| ацетилнитрат | ||||
 | 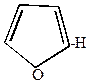 | + | 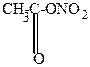 |  |
| ацетилнитрат | ||||
 | 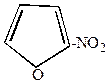 | + | 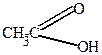 | |
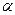 -нитрофуран -нитрофуран |
