Синтез гетероциклических соединений
3.1.
Диоксан
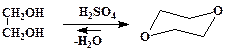 | (1) |
В круглодонной колбе на 250 мл, снабженной дефлегматором и прямым холодильником, смешивают 22,5 мл (0,4 моль) этиленгликоля и 2,4 мл серной кислоты (d = 1,84 г/мл). Смесь осторожно нагревают до кипения и собирают фракцию 84 – 102 °С до тех пор пока содержимое колбы не начнет чернеть и пениться. Полученный дистиллят высаливают поташом, верхний органический слой отделяют и высушивают гидроксидом калия, а затем перегоняют с дефлегматором собирая фракцию с температурой кипения 100 – 103 °С. Выход с 15,5 г (88 %).
Пояснения к синтезу
В этом синтезе серная кислота играет двоякую роль – водоотнимающего и протонирующего агента. В качестве дегидратирующего реагента концентрированная серная кислота смещает равновесие реакции вправо. Реакция (1) обратима, в к присутствии концентрированной серной кислоты равновесие смещается вправо.
Связи С–О этиленгликоля полярны и атомы углерода заряжены положительно. Однако этого заряда недостаточно для осуществления реакции нуклеофильного замещения. Ей предшествует равновесное протонирование одного из атомов кислорода этиленгликоля:
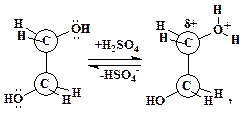 | (2) |
в результате которого дробный положительный заряд на соседнем атоме углерода резко возрастает. Этот атом далее подвергается нуклеофильной атаке второй молекулой этиленгиколя, его атомом кислорода, имеющего неподеленную электронную пару («атака с тыла», механизм реакции SN2):
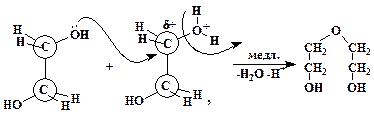
Затем указанная последовательность элементарных реакций повторяется уже внутримолекулярно с образованием 1,4-диоксана.
Трифенилпирилия перхлорат
Трифенилпирилия получают конденсацией 2 моль ацетофенона с 1 моль бензальдегида в присутствии хлорной кислоты:
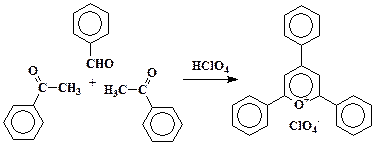
В круглодонную колбу емкостью 250 мл, снабженную обратным холодильником, помещают 4,7 мл (0,04 моль) ацетофенона, 2,1 мл (0,02 моль) бензальдегида, 5 – 6 мл толуола и 2 мл (0,02 моль) 70 %-ной НСO4 (см, прим. I к предыдущему синтезу). Смесь кипятят 3 час, охлаждают и разбавляют 150 мл эфира. Выпавший желтый осадок пирилиевой соли через 2 – 3 час отфильтровывают, промывают эфиром и высушивают сначала на воздухе, затем в вакуум-эксикаторе. Продукт перекристаллизовывают из хлороформа или ледяной уксусной кислоты. Выход 4 г (49 %). Тпл 275 – 276 °.
Пояснения к синтезу
Концентрированная хлорная кислота
Первые стадии реакции идут по типу кротоновой конденсации и включают предварительную перегруппировку ацетофенона в енольную форму:
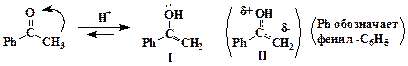
Формальная структура енола (I) неточно описывает его строение. Атомы цепочки НО-С-СН2 каждый находятся в гибридном состоянии sp2 и при взаимодействии их pz-орбиталей образуются связывающая, разрыхляющая и несвязывающая молекулярные орбитали. В результате этого электронная пара кислорода оказывается на НСМО, т.е. и на кислороде, и на углероде группы СН2, как это показывает структура (II). Этот атом приобретает свойства нуклеофила и атакует связь С=О бензальдегида, разрывая ее:
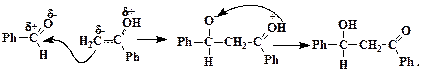
При высокой температуре и в условиях кислотного катализа промежуточный аналог альдоля отщепляет воду с образованием ненасыщенного кетона, который по уже описанной цепочке реакций конденсируется со второй молекулой ацетофенона. Завершается процесс, очевидно, реакцией окислительной циклизации:
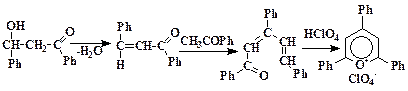
Пиррол
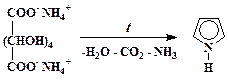
63,0 г (0,3 моль) слизевой кислоты и 90 мл 25 %-ного водного аммиака (уд. вес 0,9 г/мл) тщательно смешивают под тягой в фарфоровой чашке до образования однородной пасты. Густую массу нагревают на кипящей водяной бане при перемешивании до полного удаления воды и образования сухого порошка. Полученный слизевокислый аммоний растирают в порошок, смешивают с 35 мл глицерина в 0,5 л колбе и полученную смесь выдерживают ночь при комнатной температуре. Затем к колбе присоединяют прямой холодильник и смесь осторожно нагревают пламенем газовой горелки до 320 – 330 С. При сильном вспенивании начинает отгоняться пиррол, перегонку продолжают до тех пор, пока отгоняются капли масла. При этом общий объем дистиллата достигнет 90 – 100 мл. Маслянистый пиррольный слой отделяют и водный раствор в делительной воронке экстрагируют 10 мл эфира. Объединенный эфирный раствор и пиррольную фракцию промывают небольшим количеством воды, отделяют с помощью делительной воронки, быстро обезвоживают гидроксидом калия и перегоняют в приборе с дефлегматором (температура кипения 127 – 131°С). Выход 7,5 – 8,0 г (37 – 40 %).
Пояснения к синтезу
Механизм этой реакции не исследован, однако очевидно, что при воздействии высокой температуры происходит декарбоксилирование слизевой кислоты, дегидратация образующегося при этом тетраола, который далее вступает в реакцию конденсации с аммиаком. Видимо, замыкание цикла осуществляется подобно тому, как это происходит при синтезе хинолина (см. ниже
Глицерин необходим для гомогенизации реакционной массы и предотвращения ее местных перегревов. Источником пиррольного азота является аммиак. Растворяя его, глицерин сохраняет аммиак в реакционной системе.
Пиролиз аммонийной соли слизевой кислоты сопровождается сильным вспениванием и выделением дурно пахнущих веществ. Поэтому нагревание надо вести очень осторожно во избежание переброса реакционной масс в холодильник и отгонку проводить под тягой.
Фенилпиррол
При нагревании слизевой кислоты с анилином с умеренным выходом образуется 1-фенилпиррол:
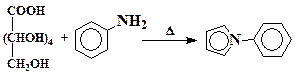
К нагретому до 150 °С анилину (121 г, 1,3 моль) (анилин ядовит, работать под тягой!) в один прием добавляют 126 г (0,6 моль) слизевой кислоты. Смесь, перемешивая, кипятят с обратным воздушным холодильником 3 – 4 часа. Затем обратный холодильник заменяют на прямой и отгоняют почти всю жидкость. Дистиллят трижды экстрагируют 80 мл порциями эфира. Эфирную вытяжку последовательно промывают 10 – 20 %-ной соляной кислотой, 5 – 10 %-ным раствором кальцинированной соды (Na2CO3), водой и затем обезвоживают плавленым хлористым кальцием. После отгонки эфира продукт перегоняют в вакууме, собирая фракцию с Ткип 110 – 116 °С (9 мм рт. ст.) или 127 – 135 °С (30 мм рт. ст.).
Сырой продукт плавится при 55 – 60 °С. После двукратной перекристаллизации из смеси этанол-вода (3:1 по объему) получают бесцветны кристаллы с Тпл 58 – 60 °С и Ткип 234 °С.
Выход 36 – 43 г (42 – 50%). УФ спектр в этаноле λmax (lg ε): 253 нм,(4,13).
Диметилпиразол
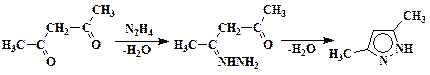
В 1 л колбе, снабженной капельной воронкой, термометром и мешалкой, растворяют 65,0 г (0,5 моль) сернокислого гидразина в 400 мл 10%-ного гидроксида натрия. Колбу охлаждают до 15 °С и прибавляют при перемешивании 50,0 г (0,5моль) ацетилацетона, затем еще 1 час перемешивают при 15 °С. К содержимому колбы добавляют 200 мл воды, переносят в делительную воронку и взбалтывают со 125 мл эфира. Слои разделяют и водный слой экстрагируют еще четыре раза порциями по 40 мл эфира. Объединенные эфирные вытяжки промывают насыщенным раствором хлорида натрия и сушат поташом. Эфир отгоняют и остаток высушивают в вакууме. Для очистки продукт можно перекристаллизовать из петролейного эфира Выход 37 – 39 г (77 – 81 %). Тпл 107 – 108 °С.
Пояснения к синтезу
Первая стадия реакции состоит в нуклеофильном присоединении азота гидразина по двойной связи С=О. Далее отщепляется молекула воды и образуется моногидразид ацетилацетона I, который за счет неподеленной электронной пары второго атома азота вступает в аналогичные внутримолекулярные превращения с образованием промежуточного продукта II. Атомы азота соединения II обладают сильными электроноакцепторными свойствами и ослабляют связи С-Н центрального метиленового звена. Миграция одного из атомов водорода группы СН2 к атому азота ведет к образованию стабильной ароматической системы π-связей, что является движущей силой реакции изомеризации:
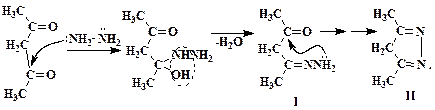
Бензимидазол
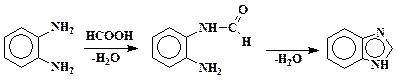
В 0,5 л колбу помещают 54,0 г (0,5 моль) орто-фенилендиамина и добавляют 32 мл (34,6 г, 0,75 моль) 90 %-ной муравьиной кислоты. Смесь нагревают на водяной бане в течение 2 час, после охлаждения к ней медленно приливают 10 %-ный раствор гидроксида натрия до щелочной реакции на лакмус. Сырой бензимидазол отсасывают на воронке Бюхнера и промывают холодной водой. Далее его растворяют в 750 мл кипящей воды, нагревают с 2 г активированного угля 15 мин и быстро фильтруют через обогреваемую воронку. Фильтрат охлаждают до 10 – 15 °С, продукт отфильтровывают, промывают холодной водой и высушивают при 100 °С. Выход 49,0 – 50,5 г (83 – 85 %). Тпл170 – 172 °С.
Пояснения к синтезу
Первая стадия – образование замещенного амида муравьиной кислоты. Вторая – разрыв двойной связи С=О с внутримолекулярным нуклеофильным присоединением аминогруппы и последующим отщеплением молекулы воды:
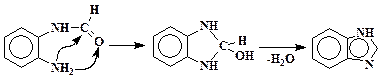
Тетрагидрокарбазол
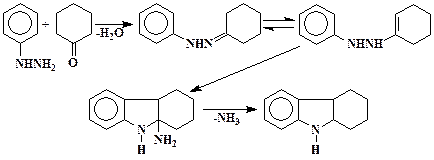
В 1 л трехгорлой колбе, снабженной обратным холодильником, мешалкой и капельной воронкой, смешивают 98 г (1,0 моль) циклогексанона и 360 г (6,0 моль) уксусной кислоты. Содержимое колбы нагревают до кипения и при перемешивании добавляют за 1 час 108 г (1,0 моль) фенилгидразина. Смесь кипятят еще 1 час и переливают в стакан при перемешивании до затвердевания. Смесь охлаждают до 5 °С, фильтруют, осадок промывают водой (100 мл), а затем 75 %-м спиртом (100 мл). Сырой препарат сушат на воздухе в течение ночи и перекристаллизовывают из 700 мл метанола с активированным углем. Выход 120 – 135 г (76 – 85 %). Тпл 115 – 116 °С.
Пояснения к синтезу
Реакция циклоконденсации при внутримолекулярной нуклеофильной атаке по эндо-положению активированной двойной связи орто-положением бензольного кольца с последующим элиминированием аммиака и образованием ароматической системы индола (синтез индолов по Фишеру).
