Закон дії мас і гетерогенні системи.Добуток розчинності та добуток активності.Розчинність малорозчинних електролітів,її обчислення
При гетерогенному каталізі каталізатор і реагують речовини знаходяться в різних фазах, найчастіше каталізатором є тверде тіло, а реагуючі речовини знаходяться в рідкому або газоподібному стані і реакція протікає на поверхні розділу двох фаз, тобто на поверхні каталізатора. Тому гетерогенні каталітичні процеси часто називають контактними, а тверді каталізатори - контактними речовинами.
При гетерогенному каталізі велике значення мають структура, хімічний склад і величина поверхні каталізатора. Як правило всі гетерогенні каталітичні реакції (навітьвідносно прості з них) протікають у кілька стадій: 1) зближеннямолекул реагуючих речовин, 2) орієнтація молекул на активних центрахкаталізатора, 3) адсорбція молекул реагуючих речовин, що супроводжуєтьсядеформацією зв'язків у молекулах, 4) хімічне перетворення адсорбованих (і активованих) молекул, 5) десорбції продуктів реакції, 6) видалення цих продуктів з поверхні каталізатора.
Швидкість гетерогенних взаємодій залежить не тільки від самої хімічної взаємодії, а й від стадії переносу речовини, яким є підведення молекул газоподібного або розчиненого реагенту з обсягу
V до реакційної поверхні S і інтенсивність відводу від поверхні продуктів реакції.
У 1865 році професор М.М. Бекетов висловив гіпотезу про взаємозв'язокміж масами реагентів і часом перебігу реакції: «... Притягненняпропорційно добутку діючих мас », яка в 1867 році булапідтверджена норвезьким хіміком К.М. Гульдбергом і П. Вааге в законідії мас. Сучасна формулювання цього закону: «при постійнійтемпературі швидкість хімічної реакції прямо пропорційна добуткуконцентрації реагуючих речовин, взятих у ступенях, рівнихстехіометричні коефіцієнти в рівнянні реакції ».
Для реакції aA + bB - mM + nN
Математичне вираження закону дії мас має вигляд:
В стані хімічної рівноваги при фіксованій температурі й тиску вільна енергія Гібса повинна мати мінімальне значення, тому
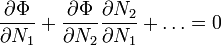 .
.
Виходячи з рівнянь реакції
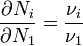 ,
,
а тому
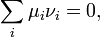
де 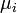 - хімічний потенціал i-го реагента. Це рівняння є загальною формою запису закону, часткову форму якого можна отримати, виразивши хімічні потенціали через концентрації.
- хімічний потенціал i-го реагента. Це рівняння є загальною формою запису закону, часткову форму якого можна отримати, виразивши хімічні потенціали через концентрації.
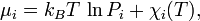 ,
,
де 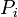 - парціальний тиск, а
- парціальний тиск, а 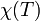 - певна функція від термператури. Парціальні тиски кожної з речовин, що беруть участь у реакції, пропорційні їхнім концентраціям. Після нескладних перетворень можна отримати
- певна функція від термператури. Парціальні тиски кожної з речовин, що беруть участь у реакції, пропорційні їхнім концентраціям. Після нескладних перетворень можна отримати
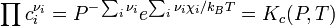 .
.
Стала хімічної рівноваги не залежить від початкової концентрації реагентів, а визначається лише тиском і температурою.
Константа швидкості k визначається природою реагуючих речовин,залежить від температури і присутності каталізатора, але не залежить відконцентрації реагентів що беруть участь в реакції.
Закон дії мас справедливий тільки для найбільш простих за своїммеханізму взаємодій, що протікають в газах або в розведених розчинах.
Якщо складна реакція є сукупністю декількох процесів,здійснюваних паралельно або послідовно, то цей закон справедливийдля кожної окремої стадії реакції, але не всього взаємодії в цілому.
Але концентрація твердої фази (вуглецю) в ході реакції не змінюється. Томуїї зазвичай містять у константу швидкості (k):
V = k const [02] = k [02],
Тобто швидкість гетерогенної реакції залежить тільки від концентраціїречовин знаходяться в газовій або рідкій фазах.
2.Перша аналітична група катіонів.Реакції виявлення та відкриття катіонів NH4+ , K+, Na+ .
До першої аналітичної групи катіонів належать NH4+, K+, Na+ та Mg2+. Сюди також відносять іони Li+, Rb+, та Cs+. Особливість першої групи катіонів полягає в тому, що вона не має групового реагенту, здатного осаджувати всі катіони цієї групи.
Дія лугу.
З катіонів першої групи лише NH4+ та Mg2+ взаємодіють з розчином лугу. Реакція NH4+ з лугом при нагріванні супроводжується виділенням аміаку:
NH4Cl + NaOH = NH3 ↑ + NaCl + H2O.
Аміак можна виявити або за запахом, або з допомогою деяких реакцій (наприклад, змочений водою рожевий лакмусовий папірець синіє, а фільтрувальний папір, змочений Hg2(NO3)2, чорніє). Ця реакція є специфічною для NH4+ і дає змогу виявити його в присутності всіх катіонів.
Дія розчину аміаку.
З катіонів першої аналітичної групи лише Mg2+ взаємодіє з аміаком, утворюючи малорозчинний Mg(OH)2 білого кольору. Проте осадження магнію не є повним, оскільки NH4OH – слабка основа, і тому концентрація ОН− в розчині недостатня. Якщо ж розчин містить надлишок солей амонію, осад Mg(OH)2 взагалі не утворюється, тому що рівновага
Mg2+ + 2 NH4OH ↔ Mg(OH)2 + 2 NH4+.
порушується вліво. Крім того, суміш NH4OH + NH4Cl має буферні властивості і створює в розчині таку концентрацію іонів водню, за якої осад Mg(OH)2 не утворюється (рН біля 9).
