Качественное определение и идентификация
Для обнаружения алкалоидов в растительном сырье чаще всего используют общие (осадочные) реакции и хроматографию. Кроме того, учитывают еще некоторые свойства алкалоидов: их растворимость в кислотах и выпадение в осадок после подщелачивания, щелочную реакцию спиртовых растворов оснований алкалоидов и др. С целью идентификации алкалоидов проводят специфические (цветные) реакции, микрокристаллоскопические реакции и хроматографи- ческий, спектроскопический, люминесцентный анализы и т. д.
Общие реакции на алкалоиды (реакции осаждения). Реакции осаждения позволяют установить наличие алкалоидов даже при незначительном их содержании. Основаны они на том, что алкалоиды при взаимодействии с некоторыми веществами образуют нерастворимые в воде соединения. Это главным образом соли тяжелых металлов, комплексные иодиды, комплексные кислоты и некоторые органические соединения кислотного характера. Для проведения качественных реакций из растительного сырья обычно готовят кислотное извлечение. При добавлении соответствующих реактивов в присутствии алкалоидов тотчас или через некоторое время образуется осадок. Обилие осадка зависит как от количественного содержания алкалоидов, так и от чувствительности их к реактиву. Однако следует учитывать, что с общими реактивами образуют осадки еще и некоторые другие органические соединения, которые могут содержаться в неочищенных извлечениях (холин, бетаин, белки, продукты их разложения и др.). Поэтому, чтобы получить более достоверные результаты, общие реакции проводят еще и с очищенными извлечениями.
Ввиду того, что чувствительность различных алкалоидов к «осадочным реактивам» неодинакова, реакции обычно проводят не с одним каким-либо реактивом, а с несколькими (5—7) различными реактивами. Наиболее часто используются следующие реактивы: Майера (раствор дихлориДа ртути и иодида калия), Вагнера и Бу- шарда (растворы иода в растворе иодида калия), Драгендорфа (раствор нитрата висмута основного и иодида калия с добавлением уксусной кислоты), Марме (раствор иодида кадмия в растворе иодида калия); раствор танина, растворы кремневольфрамовой, фосфорномо- либденовой, фосфорновольфрамовой, пикриновой кислот и др.
Специфические реакции на алкалоиды. Если необходимо установить присутствие определенного алкалоида или определенной группы алкалоидов в растительном сырье, проводят специфические реакции (цветные) и микрокристаллоскопические реакции.
Специфические реакции проводят с индивидуальными алкалоидами или с очищенной суммой алкалоидов.
Алкалоиды из растительного сырья извлекают 1—5%-ным раствором какой-либо кислоты (соляная, серная или другая). Кислотное извлечение подщелачивают раствором аммиака или другой щелочи и затем алкалоиды извлекают органическими растворителями (хлороформом, дихлорэтаном, этиловым эфиром и т. д.). Органический растворитель отгоняют или выпаривают в фарфоровой чашке и с остатком проводят соответствующие реакции. В качестве специфических реактивов на алкалоиды при проведении реакций окрашивания довольно часто используют концентрированную H2S04 и HN03, а также концентрированную H2S04, содержащую формалин (реактив Марки), концентрированную H2S04 с молибдатом аммония (реактив Фреде) и др. При проведении микрокристаллоскопических реакций — пикриновую, пикролоновую и стифниновую кислоты, роданидные и иодидные комплексы металлов и др.
Специфические реакции на индивидуальные алкалоиды подробно описаны в руководствах по фармацевтической и токсикологической химии.
Хроматографический анализ. Хроматография на бумаге и в тонком слое сорбента является ведущим аналитическим методом в фи- тохимическом анализе.
При проведении фитохимического анализа вообще и, в частности, анализа растительного сырья, содержащего алкалоиды, эти методы могут быть использованы как для обнаружения и идентификации алкалоидов, так и для контроля степени очистки и разделения суммы алкалоидов.
Хроматография на бумаге. Существует большое число различных методов «бумажной хроматографии» (БХ). Най- более простыми и часто применяемыми являются методы восходящей, нисходящей и радиальной хроматографии. При восходящей и нисходящей хроматографии на стартовую линию полосы хроматографической бумаги наносят капилляром или специальной пипеткой исследуемое извлечение и раствор «свидетеля». Объемы испытуемого извлечения и раствора «свидетеля», наносимые на хроматограмму, зависят от концентрации извлечения и раствора, а также чувствительности алкалоидов к реактиву.
Способ закрепления подготовленной хроматограммы в хроматографической камере зависит от метода хроматографирования. Система растворителей должна обеспечивать максимальное разделение алкалоидов, содержащихся в извлечении. При соприкосновении хроматограммы с жидкостью растворитель начинает медленно распространяться вдоль бумаги. Когда растворитель проходит через участок, где нанесена сумма алкалоидов, происходит растворение веществ, и они перемещаются вместе с жидкостью. На каждом участке хроматограммы происходит многократное перераспределение вещества между подвижной и неподвижной фазой, и поэтому скорость перемещения веществ по бумаге различна и зависит от его коэффициента распределения. Расстояние между стартовой линией и фронтом растворителя может быть различным (20—40 см) и зависит от разницы между Rf веществ, содержащихся в извлечении. Чем меньше разница между Rf, тем больше должно быть расстояние от стартовой линии до фронта растворителя. Экспозиция обычно от 3 до 20 ч, что определяется маркой хроматографической:бумаги, системой растворителей и др. Чаще всего используют следующие системы растворителей; 1) н-бутанол — уксусная кислота — вода (5:1: 4); 2) н-бутанол — уксусная кислота — вода (10 : 2 : 5); 3) н-бутанол — соляная кислота — вода (100 : 4: вода до насыщения); 4) этилацетат — уксусная кислота — вода (11 : 21 : 85); 5) н-бутанол — пиридин — вода (10:2:5) и др.
Для обнаружения алкалоидов высушенную хроматограмму обрабатывают каким-либо реактивом, дающим с алкалоидами окрашенные соединения. Чаще всего для этого используют реактив Драгендорфа. При обработке хроматограммы этим реактивом появляются оранжевые или оранжево-красные пятна (алкалоиды) на желтом фоне. Можно для обнаружения алкалоидов использовать пары иода (образуются бурые пятна)." Для обнаружения стероидных алкалоидов можно использовать насыщенный хлороформный раствор треххлористой сурьмы с последующим нагреванием при 105 °С. Появляется кирпично-красное окрашивание.
Хроматография в тонком слое сорбента. Тонкослойная хроматография (ТСХ) может быть использована для идентификации и при количественном определении алкалоидов в растительном сырье. Хроматографирование проводят на пластинках с закрепленным и незакрепленным слоем сорбента. В качестве сорбента используют «оксид алюминия для тонкослойной хроматографии», силикагель марки КСК и др.
Для приготовления пластинок с закрепленным слоем сорбента в качестве фиксатора применяют CaS04 • V2H20; основой служат стеклянные пластинки размером 12—20 X 8—15 см.
Извлечение и раствор «свидетеля» наносят капилляром или специальной пипеткой на стартовую линию, которая отстоит от нижнего края пластинки на 1,5—2 см. Для разделения обычно применяют способ восходящей хроматографии. Край пластинки погружают в жидкость, которую наливают в хроматографическую камеру. Слой жидкости должен быть около 5 мм. Пластинку с закрепленным слоем помещают в хроматографическую камеру, насыщенную парами растворителя, вертикально, с незакрепленным слоем — под углом 15—20°. Экспозиция от 30 мин до 1,5 ч.
Чаще всего используют следующие системы растворителей: 1) хлороформ — ацетон —диэтиламин (5:4: 1); 2) хлороформ — диэтиламин (9 : 1); 3) н-бутанол — метиловый спирт —диэтиламин (17:1:2); 4) хлороформ — метиловый спирт — уксусная кислота (18:1: 1); 5) бензол — метиловый спирт (19 t 1); 6) хлороформ — этиловый спирт (9 : 1); 7) ацетон — раствор аммиака (95 I 5); 8) хлороформ — этиловый спирт (8 : 2).
После высушивания ТС хроматограммы обрабатывают теми же реактивами, что и хроматограммы на бумаге.
Спектральный анализ. С целью идентификации алкалоидов кроме качественных реакций и хроматографического анализа определяют температуру плавления, удельное вращение, брутто формулу, молекулярную массу, получают ряд производных, определяют их константы. Кроме того, для идентификации алкалоидов широко используют УФ, ИК, ПМР, масс-спектры. При этом нет необходимости снимать одновременно спектры исследуемого вещества и известного образца, поскольку последний можно взять из литературы.
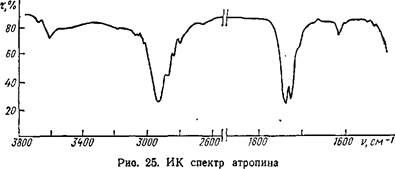
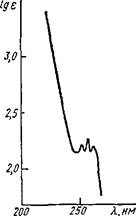
УФ, ИК, ПМР, масс-спектры особенно широко используются при установлении структуры алкалоидов, так как интерпретация спектров позволяет установить наличие или отсутствие сопряженных двойных связей и различных функциональных групп (карбонильной, N-метильной, гидроксильной и др.), ароматического цикла и др. Так, например, в ИК спектре атропина (рис. 25) полосы поглощения при 1740 см-1 указывают на наличие карбонила сложноэфир- ной связи; 2940 см"1 — спиртового гидроксила. В УФ спектре атропина (рис. 26) отмечаются Яп,ах = 252, 258, 262 нм, характерные Для сопряженных двойных связей в ароматическом цикле.
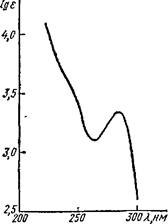
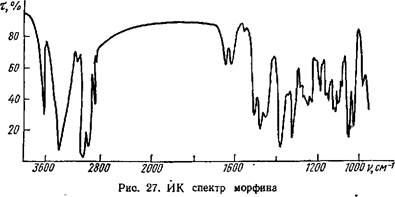
Полосы поглощения при 3220—3480 см-1 в ИК спектре морфина (рис. 27) типичны для фенольного и спиртового гидроксилов. В УФ
спектре морфина (рис. 28) Я,тах = 284 нм указывает на присутствие ароматического цикла.
 |
Методики качественного анализа. Приготовление из- влечения из растительного сырья, а) 1 г измельченного растительного сырья помещают в колбу вместимостью 100 мл, заливают 25 мл 1 %-ной НС1 и нагревают на кипящей водяной бане в течение 5 мин. После охлаждения извлечение фильтруют через бумажный фильтр (извлечение А).
б) 2 г измельченного растительного сырья помещают в колбу вместимостью 100 мл, добавляют 1 мл ГО %-ного раствора аммиака и
20 мл хлороформа и оставляют на 1 ч при периодическом перемешивании. Хлороформное извлечение отфильтровывают через вату в делительную воронку вместимостью 100 мл и алкалоиды извлекают 15 мл 1 %-ной НС1 (извлечение Б).
Качественные реакции (общие реакции, реакции осаждения). Извлечение А или Б разливают в пробирки по 1 мл и в каждую пробирку осторожно, по каплям, добавляют соответствующий реактив на алкалоиды. При наличии алкалоидов тотчас или через некоторое время должен образоваться осадок.
Интенсивность осадка зависит как от количественного содержания алкалоидов, так и от чувствительности алкалоида к реактиву.*
 Рно. 26. УФ спектр атропина Рно. 26. УФ спектр атропина |
1. Реактив Майера. С большинством алкалоидов в слабокислых и нейтральных растворах этот реактив образует белый или желтоватый осадок. Чувствительность алкалоидов к этому реактиву весьма различна: стрихнин и бруцин осаждаются в разведении 1 : 150 000, морфин — 1 : 25 000, а кофеин, колхицин реактив Майера не осаждает.
2. Реактивы Вагнера и Бушарда. С большинством алкалоидов в слабокислых растворах эти реактивы образуют бурые осадки.
 Рио. 28. УФ спектр морфина Рио. 28. УФ спектр морфина |
3. Реактив Драгендорфа. Многие алкалоиды в кислых растворах дают оранжево-красные или кирпично-красные осадки.
 |
4. Реактив Марме. С алкалоидами реактив Марме дает белые или желтоватые осадки, часто растворимые в избытке реактива. Чувствительность некоторых алкалоидов к этому реактиву невелика. Атропин, колхицин, вератрин и некоторые другие алкалоиды осаждаются из сравнительно концентрированных растворов, а кофеин этим реактивом совсем не осаждается.
5. Раствор танина. В подкисленных растворах алкалоиды дают с танином беловатые или желтоватые аморфные осадки.
6. Раствор кремневольфрамовой кислоты. Большинство алкалоидов весьма чувствительны к этому реактиву и в слабокислых растворах образуют беловатые осадки.
7. Раствор фосфор номолибденовой кислоты. Это один из наиболее чувствительных реактивов. С алкалоидами он образует желтоватые осадки, которые приобретают через некоторое время синее или зеленое окрашивание вследствие восстановления молибденовой кислоты.
8. Раствор фосфорновольфрамовой кислоты. Фосфорновольфра- мовая кислота со многими алкалоидами дает беловатые осадки.
9. Раствор пикриновой кислоты. Пикриновая кислота образует с рядом алкалоидов осадки (пикраты) желтого цвета. Некоторые алкалоиды пикриновой кислотой не осаждаются (кофеин, морфин,
аконитин, теобромин), другие же осаждаются только из концентрированных растворов (например, атропин).
10. Раствор пикролоновой кислоты. Со многими алкалоидами пикролоновая кислота дает желтые осадки (пикролонаты).
Приготовление реактивов. 1. Реактив Майера: 1,358 г дихлорида ртути растворяют в 60 мл воды, приливают раствор 5 г иодида калия в 10 мл воды и общий объем доводят водой до 100 мл.
. 2. Реактив Вагнера: 1,27 г иода растворяют в 100 мл раствора 2 г иодида калия в воде.
3. Реактив Бушарда: 1 г иода растворяют в 50 мл раствора 2 v иодида калия в воде.
4. Реактив Драгендорфа: раствор 1 — 0,85 г нитрата висмута основного растворяют в 40 мл воды и добавляют 10 мл уксусной кислоты; раствор 2—20 г иодида калия растворяют в 50 мл воды. Смешивают равные объемы растворов 1 и 2. К 10 мл полученной смеси добавляют 100 мл воды и 20 мл уксусной кислоты.
5. Реактив Марме: 10 г Cdl2 растворяют в 100 мл 20%-ного горячего водного раствора K.I.
6. Раствор танина: 10 г танина растворяют в 90 мл воды и добавляют 10 мл этилового спирта.
7. Раствор кремневольфрамовой кислоты (Si02 • 12W03 • nH20): 1 г кремневольфрамовой кислоты растворяют в воде и объем доводят водой до 100 мл.
8. Раствор фосфорномолибденовой кислоты [Н,Р(Мо207)в • Н20]: 1 г фосфорномолибденовой кислоты растворяют в воде и объем доводят водой до 100 мл.
10. Раствор фосфорновольфрамовой кислоты (Р205 • 12WOsx х42НаО): 1 г фосфорновольфрамовой кислоты растворяют в воде и объем доводят водой до 100 мл.
10. Раствор пикриновой кислоты [C6H2(0H)(N02)sh 1,23 г пикриновой кислоты растворяют в 100 мл воды.
11. Раствор пикролоновой кислоты
[QH^NOj) .CsN4(OH)(NH2)(CH3)]:
1 г пикролоновой кислоты растворяют в воде и объем доводят водой до 100 мл.
Хроматографический анализ. Приготовление извлечения из растительного сырья. 1г измельченного растительного сырья (трава термопсиса ланцетовидного, семена термопсиса ланцетовидного, листья красавки, листья дурмана обыкновенного, семена дурмана индейского и др.) помещают в колбу вместимостью 100 мл, заливают 25 мл 1 %-ной НС1 и оставляют на 1 ч при периодическом перемешивании или нагревают на кипящей водяной бане в течение 5 мин. После охлаждения извлечение фильтруют через вату в делительную воронку вместимостью 100 мл. Фильтрат подщелачивают концентрированным раствором аммиака до щелочной реакции по фенолфталеину, и алкалоиды извлекают 5 мл хлороформа (извлечение В).
1. Хроматография на бумаге (трава термопсиса ланцетовидного, семена термопсиса ланцетовидного). На полоску хроматографиче- ской бумаги (длина 30—40 см, ширина 12 см) на стартовую линию, находящуюся на расстоянии 2—3 см от нижнего края, капилляром или специальной пипеткой наносят около 0,1 мл извлечения В из травы термопсиса и из семян термопсиса, растворы цитизина, ме- тилцитизина и пахикарпина. Расстояние от бокового края полоски хроматографической бумаги и между пятнами — 2 см. Диаметр пятен не должен превышать 5 мм.
Полоску хроматографической бумаги с нанесенными на нее растворами (после высушивания) помещают в хроматографическую камеру, в которую предварительно (за сутки) налита разделительная система: м-бутанол — уксусная кислота — вода (5 : 1 : 4).
Нижний край хроматограммы погружают в жидкость примерно на 3—5 мм (экспозиция — 14—15 ч).
После высушивания хроматограмму обрабатывают (опрыскивают из пульверизатора) реактивом Драгендорфа. На желтом фоне проявляются оранжевые или оранжево-красные пятна (алкалоиды) (рис. 29).
2. Хроматография в тонком слое сорбента (трава термопсиса ланцетовидного, семена термопсиса ланцетовидного). На стеклянную пластинку (размер 12 X 9 см) с закрепленным слоем силикагеля марки- КСК на стартовую линию, находящуюся на расстоянии 1,5 см от нижнего края, наносят капилляром или специальной пипеткой около 0,1 мл извлечения В из травы термопсиса, семян термопсиса, растворы цитизина, метилцити- зина, пахикарпина. Расстояние от бокового края и между пятнами около 1,5 см. Диаметр пятен не должен превышать 5 мм. После высушивания пластинку помещают в хроматографическую камеру, в которую предварительно налита разделительная система: хлороформ — ацетон — диэтиламин (5:4i 1). Экспозиция 30—40 мин. После тщательного высушивания хроматограмму обрабатывают (опрыскивают из пульверизатора) реактивом Драгендорфа. На желтом фоне появляются оранжевые пятна (алкалоиды) (рис. 30).
| # • О о о |
 |
| 7 2 3 4 5 |
| Рис. 29. Схема хроматограммы (БХ) алкалоидов травы и семян термопсиса ланцетовидного- / — извлечение В из травы термопсиса; 2— извлечение В из семян тер- мопсиса; 3 — цитизин;4— метилдитизин; В— пахикарпин |
3. Хроматография в тонком слое сорбента (листья красавки, семена дурмана индейского). На стеклянную пластинку (размер 12x9 см) с закрепленным слоем силикагеля марки КСК на стартовую линию, находящуюся на расстоянии 1,5 см от нижнего края, наносят капилляром или специальной пипеткой около 0,1 мл извле
чения В из листьев красавки, семян дурмана индейского, растворы гиосциамина, скополамина и атропина. Расстояние от бокового края и между пятнами около 1,5 см. Диаметр пятен не должен превышать 5 мм. После высушивания пластинку помещают в хромато- графическую камеру, в которую предварительно налита разделительная система: хлороформ — ацетон — диэтиламин (5:4:1) — система I или ацетон — раствор аммиака (95 : 5) — система II.
| О о О © © • • | © ф © © © # @ О о |
| 7 2 3 4-5 | /234 S |
Рис. 31. Схема хроматограммы (ТСХ) листьев красавки и семян дурмана индейского (система1):
| Рио. 30. Схема хроматограммы (ТСХ) алкалоидов травы и семян термопсиса ланцетовидного: 1 — извлечение В из трава термопсиса; 2 — извлечение В из семян термопсиса; 3— цитизин; 4— метилцитизин:5— пахикарпин |
/— извлечение В из листьев красавки; 2— извлечение В из сенян дурмана индейского; 3 — гиосциэмин; 4 — скополамин;В — атропин
 Рис. 32. Схема хроматограммы (ТСХ) листьев красавки и семян дурмана индейского (система II): Рис. 32. Схема хроматограммы (ТСХ) листьев красавки и семян дурмана индейского (система II): |
J— извлечение В из листьев красавки; 2 — извлечение В из семян дурмана индейского; 3 — гиосдиамин; 4— скополамин; 5 — атропин
Толщина слоя жидкости около 5 мм. Экспозиция 30—40 мин. После тщательного высушивания хроматограмму обрабатывают (опрыскивают из пульверизатора) реактивом Драгендорфа. На желтом фоне появляются оранжевые пятна (алкалоиды), рис. 31 и 32.
Реактивы и оборудование: НС1 1%-ная; аммиак, конц. р-р; СН3СООН; н-бутанол; хлороформ; ацетон; диэтиламин; кремневольфрамовая кислота; фосфорновольфрамовая кислота; фосфорномолибденовая кислота; пикриновая кислота; пикролоновая кислота; танин; реактивы Майера, Бушарда, Вагнера, Марм'е, Драгендорфа; силикагель марки КСК; CaS04; цитизин; метилцитизин; пахикарпин; гиосциамин; скополамин; атропин.
Фенолфталеиновая бумага; бумага хроматографическая марки «С»; бумага фильтровальная; воронки делительные вместимостью 100 мл; колбы плоскодонные вместимостью 100 мл; цилиндры мерные на 10, 50 и 100 мл; воронки стеклянные для фильтрования диаметром 5 см; пробирки стеклянные; камеры хромато- графические для ТСХ и БХ; пластинки стеклянные для ТСХ размером 12 X X 9 см; капилляры стеклянные; весы ручные; штативы для делительных воронок; штативы для пробирок; бани водяные лабораторные; пульверизатор.
