См.выше, ибо все одно и тоже ;)
M(вещества)
w(вещества)= ——————
M(раствора)
Массовую долю можно выражать и в процентах:
M(вещества)
w(вещества) = —————— · 100%.
M(раствора)
Раствор состоит из растворенного вещества и растворителя, поэтому массу раствора определяют по формуле:
m(раствора) = m(вещества) + m(растворителя).
Массу раствора можно выразить и через объем раствора и его плотность:
m(раствора) = V · ρ,
где V – объем рствора (см3, мл); ρ («ро») – плотность раствора (г/см3, г/мл).
Тогда:
M(вещества)
w(вещества) = ——————
V ·ρ
7Эквивалент – это часть молекулы (атома) вещества, равноценная в химической реакции одному атому или иону водорода или одному электрону. Соответственно, молярная масса эквивалента вещества – это масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода или количеству электронов 1 моль.
Расчет молярной массы эквивалента вещества осуществляется по следующим правилам:
- Химические элементы.
Мэ = М / n
Где Мэ – молярная масса эквивалента элемента, М – молярная масса элемента, n - валентность.
- Кислоты и основания.
Мэ = М / n
Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – основность кислоты или кислотность (количество групп ОН) основания.
- Соли и оксиды.
Мэ = М / (N * n)
Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, N – количество катионов в формуле, n – формальный заряд катиона.
- Окислители и восстановители.
Мэ = М / n
Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – количество электронов, присоединяемое одной молекулой окислителя или отдаваемое одной молекулой восстановителя.
Молярная масса одного итого же вещества может рассчитываться по – разному, в зависимости от его химических свойств.
Для экспериментального определения молярной массы эквивалента вещества необходимо найти массу данного вещества, равноценную в химической реакции молярной массе эквивалента другого известного вещества.
8 Моляльная концентрация вещества (моляльность) Сm(х) или в(х)
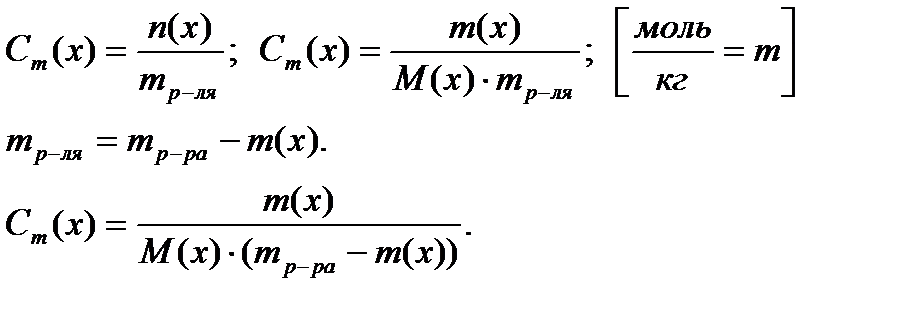
Титр раствора (от фр. titre — качество, характеристика) — способ выражения концентрации, применяемый, в основном, в аналитической химии. Обозначается заглавной латинской буквой T (тэ). Измеряется в г/мл (г/см³).
Различают титр по растворённому веществу и титр по определяемому веществу (условный титр).
Титр по растворённому веществу или просто титр — масса растворённого вещества (в граммах), содержащаяся в одном миллилитре (см³) раствора.
Рассчитывается по формуле:
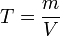
где
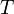 — титр раствора (в г/мл)
— титр раствора (в г/мл)
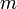 — масса растворённого вещества (в г)
— масса растворённого вещества (в г)
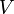 — объём раствора (в мл)
— объём раствора (в мл)
Титр по определяемому веществу или условный титр — масса какого-либо вещества (в граммах), реагирующая с одним миллилитром данного раствора. Иными словами: масса определяемого вещества, оттитровываемая одним миллилитром раствора.
Рассчитывается по формуле:
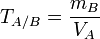
где
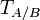 — титр раствора вещества A по веществу B (в г/мл)
— титр раствора вещества A по веществу B (в г/мл)
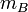 — масса вещества B, взаимодействующего с данным раствором (в г)
— масса вещества B, взаимодействующего с данным раствором (в г)
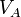 — объём раствора вещества A (в мл)
— объём раствора вещества A (в мл)
Условный титр и титр по растворённому веществу связаны следующей формулой:
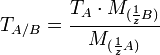
где
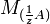 и
и 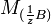 — молярные массы эквивалентов веществ A и B соответственно.
— молярные массы эквивалентов веществ A и B соответственно.
Мольная доля растворенного вещества - безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
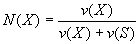 (3)
(3)
где N(Х) - мольная доля растворенного вещества X; v(Х) - количество растворенного вещества X, моль; v(S) - количество вещества растворителя S, моль.
Нетрудно представить, что сумма мольных долей растворенного вещества и растворителя равна 1:
N(X) + N(S) = 1. (4)
При решении многих задач полезно переходить от молярной концентрации к массовой доле, мольной доле и т.д. Например, молярная и процентная концентрации взаимосвязаны так:
C(X) = 10 ∙ ω(X) ∙ ρ / M(X), (5)
ω(X) = C(X) ∙ M(X) / (10 ∙ ρ) (6)
где ω(Х) - массовая доля растворенного вещества, выраженная в %; М(Х) - молярная масса растворенного вещества, г/моль; р = m/(1000 V) - плотность раствора, г/мл.
Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками, выражают через так называемый коэффициент растворимости или просторастворимость вещества.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости:
ks = mв-ва / mр-ля . (7)
Растворимость вещества s показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
см.выше, ибо все одно и тоже ;)
