Растворы. дисперсные системы 6 страница
7.36. При получении золота используется реакция его вытесне-ния из цианистых электролитов с использованием цинка:
Zn + 2K[Au(CN)2] = 2Au + K2[Zn(CN)4].
Рассчитайте, какая масса золота может быть получена, если на протекание реакции израсходовано 120 г дицианоаурата калия.
7.37. Пирометаллургический метод получения цинка из цинко-вых руд включает удаление серы по реакции
2ZnS + 3O2 = 2ZnO + 2SO2↑
с последующим восстановлением цинка:
ZnO + C = Zn + CO↑.
Рассчитайте, какая масса цинка может быть получена, если на удаление серы затрачено 45 л кислорода в расчете на нормальные условия.
7.38. Карбид хрома Cr3C2 образуется или при непосредственном взаимодействии хрома с углеродом, или оксида Cr2O3 в атмосфере СО. Напишите уравнения химических реакций и рассчитайте, какая масса карбида может быть получена из 10 кг хрома в том и другом случаях.
7.39. Ртуть – малоактивный элемент и ее получают прямым окислением киновари HgS кислородом при 600–700 оС.
Напишите уравнение химической реакции и рассчитайте массу ртути, которая может быть получена из 150 кг киновари, если потери составляют 12 %.
7.40. Алюминий используется для получения кремния путем восстановления кварцевого песка SiO2.
Напишите уравнение химической реакции получения кремния методом металлотермии и рассчитайте, какая масса алюминия потребуется для получения 50 кг кремния.
7.41. Сурьма активно взаимодействует с хлором. Рассчитайте, какая масса пентахлорида сурьмы может быть получена из 30 кг металла и какой объем хлора расходуется на проведение реакций? (Расчет вести для н.у.).
7.42. Соль рутения – рутенат калия получена по реакции
5Ru + 4KOH + 6KNO3 = 5K2RuO4 + 3N2 + 2H2O.
Рассчитайте, сколько литров раствора КОН плотностью 1,18 г/см3 и массовым содержанием КОН ω = 20,5 % потребуется для получения 180 г рутената калия?
7.43. При восстановлении хлорида цезия карбидом кальция получается цезий, загрязненный углем.
Напишите уравнение химической реакции получения цезия и рассчитайте степень загрязнения цезия углем (ω, % масс.), если в реакцию вступило 40 г СаС2.
7.44. Магний получают из оксида путем восстановления кремнием по реакции в вакууме
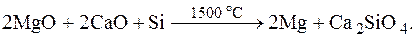
Рассчитайте массу оксидов кальция и магния, а также кремния, которая необходима для получения 1 кг магния.
7.45. Для получения металлического олова из силикатов смесь силиката олова, оксид кальция и уголь прокаливают при 1200 оС
SnSiO3 + CaO + C = Sn + CaSiO3 + CO.
Рассчитайте, какая масса шлака в виде силиката кальция всплывает на поверхность расплавленного металла при получении 2 т олова?
ХИМИЯ НЕМЕТАЛЛОВ
Решение типовых задач
Пример 8.1. Для йода (53I) определите валентные электроны в нормальном и возбужденном состоянии. Укажите возможные степени окисления. Опишите физические и химические свойства.
Р е ш е н и е
Напишем распределение электронов для 53I.
1s22s22p63s23p64s23d104p65s24d105p5.
Определим валентные электроны йода
Нормальное состояние





| |
| |
| |


| |
степени окисления: –1; 0; +1;
Возбужденное состояние
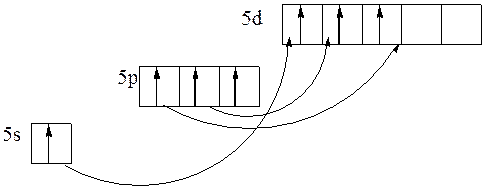
степени окисления: –1; 0; +1; +2; +3; +4; +5; +6; +7.
Йод при обычных условиях представляет собой чернофио-летовые кристаллы с металлическим блеском. Тпл. = 113,6 оС. Ткип. = = 184,3 оС. При обычных условиях растворимость йода составляет 0,02 г на 100 г воды. В органических растворителях (бензин, спирт и др.) йод растворяется значительно лучше.
Получают йод окислением йодидов хлором, извлекают из селитры и морских водорослей. Мировое производство йода составляет 10 тыс. т в год.
Йод находит применение в производстве чистых металлов и полупроводниковых материалов; как антисептик; для йодирования поваренной соли.
Йод токсичен, его ПДК составляет 1 мг/м3.
Йод достаточно сильный окислитель, о чем свидетельствует потенциал реакции I2 + 2 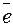 = 2 I
= 2 I 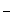 , равный 0,54 В.
, равный 0,54 В.
Пример 8.2. Напишите уравнения реакции взаимодействия азота с простыми веществами (Mg и Cl2). Какие химические свойства проявляет азот в этих реакциях? Чем можно объяснить его способность взаимодействовать с окислителями и восстановителями? Назовите продукты реакций.
Р е ш е н и е
При высоких температурах азот окисляет многие металлы, образуя нитриды, например
3Mg + N2 = Mg3N2.
Mg3N2 – нитрид магния – кристаллическое вещество, химически довольно активное, легко разлагается водой, образуя щелочь и аммиак.
При взаимодействии с галогенами азот образует нитриды галогенов. Нитриды галогенов – эндотермические соединения, например
N2 + 3Cl2 = 2Cl3N, ΔН 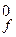 = 229 кДж/моль.
= 229 кДж/моль.
Нитрид хлора – кислотное соединение, легко разлагающееся со взрывом по реакции
3H2O + Cl3N = NH3 + 3HClO.
При образовании нитридов элементов азот ведет себя как окислитель. Азот является восстановителем лишь при взаимодействии со фтором и кислородом, образуя трифторид азота и различные оксиды азота соответственно.
Прямым взаимодействием простых веществ образуется лишь NO – оксид азота (II)
½ N2 (г) + ½ O2 (г) = NO (г).
NO – бесцветный газ, в природе образуется при грозовых разрядах по цепной реакции
О2 + hυ → O• + •O•
+ •
N2 → NO + •N•
+ O2 → NO + •O• и т.д.
NF3 – трифторид азота – бесцветный газ, получается при окислении аммиака фтором. NF3 химически устойчив, вступает в реакции при температуре выше 100 оС, кислотное соединение
NF3 + 3H2O (пар) = N2O3 + 6HF.
Пример 8.3. Опишите способы получения хлора. Напишите уравнения реакций и условия их протекания, принципиальную схему получения.
Р е ш е н и е
В лабораторных условиях хлор получают из соляной кислоты, действуя сильными окислителями. Чаще всего применяют оксид марганца (IV) MnO2 и перманганат калия KMnO4. В этих соединениях окислителем является марганец со степенями окисления +4 и +7. Выделение хлора сразу можно обнаружить по характерному удушливому запаху
4HCl (конц.) + MnO2 → MnCl2 + Cl2↑ + 2H2O.
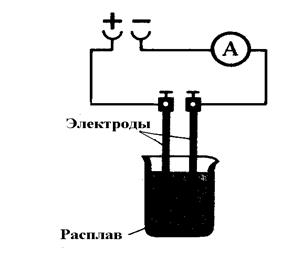
В промышленности хлор получают электролизом расплав-ленного хлорида натрия
|
На катоде: На аноде:
Na+ + 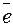 → Na0 2Cl
→ Na0 2Cl 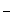 – 2
– 2 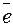 → Cl2↑
→ Cl2↑
Пример 8.4.Опишите окислительно-восстановительные свойст-ва неметаллов. Уравняйте окислительно-восстановительные реакции ионно-электронным методом.
Дана реакция
I2 + Cl2 + H2O = HCl + HIO3.
Р е ш е н и е
1. Проставим степени окисления всех элементов, чтобы определить окислитель и восстановитель
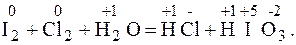
2. У хлора степень окисления понижается, следовательно он выполняет роль окислителя (принимает электроны), а у йода степень окисления повышается, он играет роль восстановителя (отдает электроны). Вода играет роль среды.
3. Запишем полуреакции окисления и восстановления, найдем наименьшее общее кратное и проставим соответствующие коэффициенты


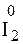 – 10
– 10 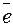 + 6H2O → 2(IO3)– + 12H+ 1
+ 6H2O → 2(IO3)– + 12H+ 1
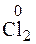 + 2
+ 2 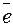 → 2Cl– 5
→ 2Cl– 5
4. Кислород уравниваем в форме Н2О, водород – в форме Н+.
5. Суммируем левые и правые части полуреакций, умножив на соответствующие коэффициенты
I2 + 6H2O + 5Cl2 → 2(IO3)– + 12H+ + 10Cl–.
6. Добавив к ионам связанные с ними частицы, составляем полное уравнение со всеми стехиометрическими коэффициентами
I2 + 5Cl2 + 6H2O → 10HCl + 2HIO3.
Пример 8.5. Напишите формулы оксидов селена и соответствующих им кислот, назовите эти кислоты и образуемые ими соли.
Р е ш е н и е
| Элемент | Оксид | Формула кислоты | Название кислоты | Название соли |
| Se | SeO2 | H2SeO3 | Селенистая | Селенит |
| Se | SeO3 | H2SeO4 | Селеновая | Селенат |
Задачи
8.1. Для данного неметалла определите валентные электроны в нормальном и возбужденном состоянии. Укажите возможные степени окисления. Опишите физические свойства неметаллов.
Т а б л и ц а 8.1
| Вариант | Неметалл | Вариант | Неметалл |
| С | 1’ | Kr | |
| Si | 2’ | Xe | |
| N | 3’ | Rn | |
| P | 4’ | At | |
| As | 5’ | Se | |
| O | 6’ | B | |
| S | 7’ | Si | |
| Se | 8’ | P | |
| F | 9’ | Cl | |
| Cl | 10’ | N | |
| Br | 11’ | Br | |
| Ar | 12’ | S | |
| At | 13’ | Ar | |
| Ne | 14’ | I | |
| I | 15’ | O |
8.2. Напишите уравнения реакций взаимодействия данного неметалла с простыми веществами. Какие химические свойства проявляет неметалл в этих реакциях? Как можно объяснить его способность взаимодействовать с восстановителями и окислителями? Назовите продукты реакций.
Т а б л и ц а 8.2
| Вариант | Неметалл | Вещество | Вариант | Неметалл | Вещество |
| Cl2 | Na | 1’ | P | Ca | |
| Cl2 | Cu | 2’ | P | Na | |
| Cl2 | Fe | 3’ | P | Al | |
| Cl2 | H2 | 4’ | C | O2 (недост.) | |
| S | F2 | 5’ | C | O2 (изб) | |
| S | O2 | 6’ | C | F2 | |
| S | H2 | 7’ | C | S | |
| S | Na | 8’ | C графит | H2 | |
| S | Mg | 9’ | C графит | Ca | |
| S | Al | 10’ | C графит | Al | |
| P | F2 | 11’ | C графит | Si | |
| P | Cl2 | 12’ | C графит | O2 | |
| P | O2 | 13’ | Si | O2 | |
| P | S | 14’ | Si | Cl2 | |
| P | Mg | 15’ | Si | Mg |
8.3. Опишите способы получения неметалла. Напишите уравнения реакций и условия их протекания, принципиальную схему получения.
Т а б л и ц а 8.3
| Вариант | Неметалл | Вариант | Неметалл |
| O2 | Te | ||
| S | At2 | ||
| F2 | B | ||
| Br2 | P | ||
| I2 | As | ||
| Se | Ar | ||
| C | Ne | ||
| N2 |
8.4. Опишите окислительно-восстановительные свойства неме-таллов. Уравняйте окислительно-восстановительные реакции ионно-электронным методом.
Т а б л и ц а 8.4
| Вариант | Реакция |
| Br2 + Cl2 + H2O = HBrO3 + HCl | |
| At2 + HClO + H2O = HAtO3 + HCl | |
| Cl2 + KIO3 + KOH = K2IO6 + KCl + 3H2O | |
| F2 + NaBrO3 + NaOH = NaBrO4 + NaF + H2O | |
| I2 + H2O2 = HIO3 + H2O | |
| Br2 + H2S + H2O = H2SO4 + HBr | |
| S + NaOH = Na2S + Na2SO3 + H2O | |
| Cl2 + H2O + Na2S2O3 = Na2SO4 + S + HCl | |
| Se + KOH = K2SeO3 + K2Se + H2O | |
| I2 + KOH + NH2OH = N2 + KI + H2O | |
| As + HNO3 + H2O = H3AsO4 + NO | |
| Si + HNO3 + HF = H2SiF6 + NO + H2O | |
| Si + H2O + KOH = K2SiO3 + 2H2 | |
| I2 + HNO3 = HIO3 + NO + H2O | |
| Cl2 + NaOH = NaCl + NaClO + H2O | |
| 1’ | Cl2 + KOH 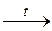 KCl + KClO3 + H2O KCl + KClO3 + H2O |
| 2’ | I2 + NO + H2SO4 + H2O = NaNO2 + NaI + H2SO4 |
| 3’ | I2 + NaHSO4 + H2O + MnSO4 = NaI + H2SO4 + MnO2 |
| 4’ | S + MnSO4 + K2SO4 + H2O = KMnO4 + H2S + H2SO4 |
| 5’ | S + K2SO4 + Cr2(SO4)3 + H2O = K2Cr2O7 + H2S +H2SO4 |
| 6’ | I2 + K2SO4 + NO2 + H2O = KI + HNO3 + H2SO4 |
| 7’ | Br2 + MnSO4 + Na2SO4 + K2SO4 + H2O = KMnO4 + NaBr + H2SO4 |
| 8’ | Cl2 + MnCl2 + KCl + H2O = KMnO4 + HCl |
| 9’ | Br2 + KOH + CrCl3 = K2CrO4 + KBr + H2O + KCl |
| 10’ | I2 + Na2SO4 + K2SO4 + H2O = Na2SO3 + KIO3 + H2SO4 |
| 11’ | I2 + NO + K2SO4 + H2O = KI + KNO2 + H2SO4 |
| 12’ | Cl2 + MnSO4 + NaHSO4 + H2O = MnO2 + NaCl + H2SO4 |
| 13’ | I2 + Cr2(SO4)3 + K2SO4 + H2O = K2Cr2O7 + KI + H2SO4 |
| 14’ | P + H2SO4 = H3PO4 + SO2 + H2O |
| 15’ | I2 + HNO3 = HIO3 + NO + H2O |
8.5. Напишите формулы оксидов селена и соответствующих им кислот, назовите эти кислоты и образуемые ими соли.
Т а б л и ц а 8.5
| Вариант | Элемент | Вариант | Элемент | Вариант | Элемент |
| N | C | Cl | |||
| P | Cl | Si | |||
| As | I | S | |||
| B | P | N | |||
| Br | S | P |
8.6. Определите массовую долю хлора в соединениях: KClO, KClO2, KClO3, KClO4. Назовите эти соединения.
8.7. Определите, как изменяется устойчивость соединений хлора в ряду: HClO – HClO3 – HClO4. Какое из соединений является самым сильным окислителем и почему?
8.8. Определите объем образовавшегося газа (при н.у.) при разложении 2,45 г бертолетовой соли. Напишите уравнение реакции.
8.9. В 5 л воды растворили 11,2 л газообразного триоксида серы. Рассчитайте молярную концентрацию полученного раствора.
8.10. Составьте уравнения реакций гидролиза трихлорида и трифторида бора. Укажите все возможные продукты реакций.
8.11. Рассмотрите проявление диагональной периодичности свойств в направлении бор → кремний. Укажите свойства, сходные для бора и кремния и одновременно различные для бора и алюминия, на примерах оксидов, гидроксидов, галогенидов и гидридов.
8.12. Напишите уравнения реакций взаимодействия фторидов натрия, алюминия, кремния, фосфора с водой. Какие свойства (основные, кислотные, амфотерные) по отношению к воде проявляют данные соединения?
8.13. Напишите уравнения реакций взаимодействия хлоридов магния, алюминия, фосфора и серы с водой. Какие свойства (основные, кислотные, амфотерные) проявляют данные хлориды?
8.14. Напишите уравнения реакций взаимодействия нитридов натрия, алюминия, фосфора и серы с водой. Какие свойства по отношению к воде проявляют данные соединения (основные, кислотные, амфотерные)?
8.15. Напишите уравнения реакций гидролиза следующих солей: Na2SO3, NaHSO3. Определите рН раствора. Вычислите рН 0,001 М раствора Na2SO3.
8.16. Как изменяются кислотные и окислительно-восстанови-тельные свойства в ряду серная – селеновая – теллуровая кислоты? Дайте обоснованный ответ. Напишите уравнения соответствующих реакций.
8.17. Сравните устойчивость, окислительно-восстановительные и кислотные свойства следующих кислот: сернистая, селенистая, теллуристая. Составьте уравнения соответствующих реакций.
8.18. Рассчитайте объем сернистого газа, необходимого для восстановления 16,0 г хлорноватой кислоты до хлороводорода (н.у.). Запишите уравнение реакции.
8.19. Приведите примеры соединений азота, в которых осуществляется донорно-акцепторный механизм образования ковалентной связи.
8.20. Известны несколько аллотропных модификаций фосфора. Дайте краткую характеристику каждой модификации.
8.21. Укажите все аллотропные модификации углерода и различия в их свойствах.
8.22. Укажите все аллотропные модификации мышьяка и различия в их свойствах.
8.23. С позиций метода ВС опишите строение молекул СН4, С2Н6, С2Н4, С2Н2. Какие типы гибридизации АО характерны для углерода в этих соединениях?
8.24. Карбид кальция получают восстановлением углерода по реакции
СаО + С = СаС2 + СО.
Вычислите массу СаО, необходимую для получения 4,5 т СаС2. Какой объем СО при этом образуется (н.у.)?
8.25. Напишите уравнения реакций, доказывающих кислотный характер оксидов SeO2, SO3, P2O5.
8.26. Составьте формулы нормальных и кислых солей натрия, образованных мышьяковистой кислотой.
8.27. Составьте формулы нормальных и кислых солей натрия, образованных фосфорной кислотой.
8.28. Составьте формулы нормальных и кислых солей натрия, образованных мышьяковой кислотой.
8.29. Составьте формулы нормальных и кислых солей натрия, образованных селенистой кислотой.
8.30. Составьте формулы нормальных и кислых солей натрия, образованных селеновой кислотой.
8.31. Составьте формулы соединений из указанных неметаллов:
Si, P, Cl, H.
8.32. Какой объем водорода (н.у.) потребуется для восстанов-ления оксида меди (II), полученного при термическом разложении гидрооксида меди (II) массой 19,6 г? Приведите уравнения химических реакций.
8.33. Смешали 1 л хлора и 2 л водорода (н.у.). Сколько граммов хлороводорода можно получить из такой смеси? Чему будет равен объем смеси после реакции?
8.34. Определите объем хлора, который может быть получен при взаимодействии 2 моль хлороводорода и 3 моль оксида марганца (IV). Приведите уравнение реакции.
8.35. Рассчитайте объем хлороводорода, полученный при взаи-модействии 20 л хлора с водородом.
8.36. Применяемая в медицине йодная настойка является 5 % раствором кристаллического йода в спирте. Какой объем спирта, плотность которого равна 0,8 г/мл, требуется для приготовления 250 г такого раствора?
8.37. Найдите, какая масса кислорода вступила в реакцию, если получено 71 г оксида фосфора (V).
8.38. Найдите, какая масса кислорода вступила в реакцию, если получено 4,4 г оксида углерода (IV).
8.39. Найдите, какая масса кислорода вступила в реакцию, если получено 4 г оксида магния.
8.40. Найдите, какая масса кислорода вступила в реакцию, если получено 4,5 г оксида азота (II).
8.41. Определите массу 1 л смеси, содержащей 10 % озона и 90 % кислорода.
8.42. Рассчитайте количество кислорода, выделившееся при разложении 1 моля пероксида водорода Н2О2.
8.43. Рассчитайте количество кислорода, выделившееся при раз-ложении 1 моля хлората калия KClO3.
8.44. Вычислите массу сульфида цинка, которая образуется при взаимодействии 2,24 л сероводорода (н.у.) с раствором нитрата цинка. Приведите уравнение реакции.
8.45. Какое количество сернистого газа можно получить из 1 т руды, содержащей 48 % пирита?
8.46. Вычислите массовую долю сероводородной кислоты в растворе, полученном при растворении 44,8 л (н.у.) сероводорода в 20 л воды.
8.47. Сколько граммов сернистого газа выделится при взаимо-действии 6,4 г меди с концентрированной серной кислотой?
8.48. Рассчитайте массу сульфита натрия, необходимого для получения 5,6 л SO2 (н.у.). Приведите уравнение реакции.
8.49. Какое количество серы выпадает в осадок при пропускании 11,2 л сероводорода (н.у.) через раствор, содержащий 41 г серной кислоты?
8.50. Сколько литров и молей аммиака требуется для получения 6,3 т азотной кислоты.
8.51. Какую массу фосфорита, содержащую 70 % Са3(РО4)2, нужно взять, чтобы получить из него 500 кг фосфора?
8.52. При нагревании 20 г гидрокарбоната натрия выделилось 2,24 л оксида углерода (IV) при н.у. Какая массовая доля (в %) гидрокарбоната разложилась?
8.53. Сколько молекул SO2 получается при сгорании 2,0·10-6 кг серы?
8.54. В какой массе четыреххлористого углерода CCl4 содержится столько же молекул, сколько их в 5,0·10-3 м3 воды?
8.55. Какой объем хлора необходимо пропустить через 0,35 л 0,2 н раствора тиосульфата натрия до окисления его в серную кислоту?
8.56. Какой объем азота может быть получен при термическом разложении 1 кг нитрита аммония, если потери составляют 12 %?
8.57. Вычислите массу фосфора, которую надо сжечь для получения оксида фосфора (V) массой 3,55 г.