Классификация методов гравиметрического анализа
Лекция 7
Гравиметрический анализ (гравиметрия)
Общее понятие о гравиметрическом анализе
Гравиметрический (весовой) анализ, или гравиметрия - это один из методов количественного анализа, основанный на определении массы искомого компонента анализируемого образца путем измерения — точного взвешивания — массы устойчивого конечного вещества известного состава, в которое полностью переведен данный определяемый компонент.
Так, при гравиметрическом определении серной кислоты в водном растворе к этому раствору прибавляют водный раствор соли бария (например, хлорида бария ВаСl2). Выпадает малорастворимый в воде белый осадок сульфата бария:
BaCl2 + H2SO4 ®BaSO4 ¯+2HCl
Осаждение проводят в таких условиях, в которых практически весь сульфат-ион переходит в осадок BaSO4 с наибольшей полнотой — количественно, с минимальными потерями (например, вследствие незначительной, но все же имеющейся растворимости сульфата бария в водном растворе). Осадок сульфата бария отделяют от маточного раствора, промывают для удаления растворимых примесей, высушивают, прокаливают для удаления сорбированных летучих примесей и взвешивают в виде чистого безводного сульфата бария на аналитических весах. Зная массу полученного сульфата бария, рассчитывают массу серной кислоты в исходном анализируемом растворе.
Другой пример — гравиметрическое определение хинина гидрохлорида в лекарственном препарате. Точную навеску препарата хинина гидрохлорида (около 0,5 г) растворяют в воде, добавляют раствор щелочи NaOH. Гидрохлорид хинина переходит в хинин. Образовавшийся хинин экстрагируют хлороформом. Отделяют хлороформный слой, содержащий хинин, хлороформ отгоняют. Остаток, состоящий из чистого хинина, высушивают, взвешивают и рассчитывают содержание хинина в исходном образце хинина гидрохлорида.
Гравиметрия — классический метод количественного химического анализа, один из первых, основательно разработанных количественных методов химии. Как уже отмечалось в главе 1, гравиметрические методы обладают простотой выполнения, хорошей воспроизводимостью, высокой точностью, хотя нередко они трудоемки и продолжительны. Гравиметрия — фармакопейный метод анализа. Разработаны многочисленные способы и методики гравиметрического определения химических элементов и их соединений.
Классификация методов гравиметрического анализа
Согласно распространенной классификации гравиметрических методов, по способу отделения определяемого компонента различают: методы осаждения, отгонки, выделения, термогравиметрические методы (термогравиметрия). Последнюю группу методов иногда относят к инструментальным.
Методы осаждения. Сущность их состоит в следующем. Определяемый компонент раствора вступает в химическую реакцию с прибавляемым реагентом — осадителем, образуя малорастворимый продукт — осадок, который отделяют, промывают, высушивают (при необходимости прокаливают) и взвешивают на аналитических весах. Примерами могут служить определение сульфат-ионов или катионов бария в форме сульфата бария BaSO4 определение массовой доли железа в растворимых солях железа, основанное на осаждении железа(Ш) в форме гидроксида Fe(OH)3 • хН2Ос последующим его отделением и прокаливанием до оксида Fе2О3; определение кальция путем осаждения его в форме оксалата кальция CaC2O4 • Н2О и либо с последующим взвешиванием CaC2O4 • Н2О или безводного CaC2O4, либо переводом в карбонат СаСО3, оксид СаО, сульфат CaSO4; определение никеля в форме бисдиметилглиоксима никеля(II) NiL2 где L — однократно депротонированный остаток диметилглиоксима (CН3СNOH)2 —и т.д.
Методы отгонки. Определяемый компонент выделяют из анализируемой пробы в виде газообразного вещества и измеряют либо массу отогнанного вещества (прямой метод), либо массу остатка (косвенный метод).
Так, при определении содержания CO2 в карбонате кальция СаСО3 методом отгонки анализируемый образец (навеску) карбоната кальция растворяют в кислоте:
СаСО3 + 2НСl ® СО2 + CaCl2 + Н2O
Выделяющийся диоксид углерода количественно поглощают и измеряют его массу по увеличению общей массы поглотителя.
Прямой метод отгонки применяют для определения содержания воды в анализируемых образцах, например в лечебных препаратах (фармакопейный метод). Для этого в стеклянную колбу вместимостью 250—500 мл, соединенную с обратным холодильником и градуированным приемником для сбора жидкого конденсата, вносят навеску анализируемой пробы массой 10—20 г, прибавляют 100 мл толуола или ксилола и кипятят содержимое колбы. Вода, присутствующая в анализируемой пробе, медленно испаряется при кипячении смеси и затем конденсируется в обратном холодильнике, стекая по каплям в приемник. После окончания отгонки воды и охлаждения приемника до комнатной температуры измеряют объем собранной в приемнике воды и, учитывая ее плотность, рассчитывают массу отогнанной воды. Зная массу воды и массу исходной пробы, рассчитывают содержание воды в анализируемом образце.
Косвенные методы отгонки широко применяют для определения содержания летучих веществ (включая слабосвязанную воду) в лекарственных препаратах, измеряя потерю массы анализируемого образца при его высушивании в термостате (в сушильном шкафу) при фиксированной температуре. Конкретные условия (температура, продолжительность высушивания и т. д.) определяются природой анализируемого объекта и указываются в методике анализа.
В типичном эксперименте для проведения анализа навеску (около 0,5—1,0 г) анализируемого образца, взвешенную на аналитических весах с точностью ±0,0002 г, помещают в сухой (предварительно взвешенный) бюкс или тигель, вносят в термостат (сушильный шкаф) и выдерживают в течение примерно двух часов при заданной температуре (часто около 100—110 °С), при которой удаляются пары слабосвязанной воды и летучих веществ. Затем бюкс (тигель) быстро переносят в эксикатор с осушителем, охлаждают, выдерживая 30—50 мин при комнатной температуре, после чего бюкс (тигель) взвешивают вместе с содержимым на аналитических весах.
Описанную операцию повторяют, помещая снова образец в термостат (сушильный шкаф) уже на менее продолжительное время — около часа. Повторные операции проводят до достижения постоянной массы бюкса (тигля) с образцом. Анализ обычно заканчивают тогда, когда разность между двумя последними взвешиваниями не превышает погрешности взвешивания на аналитических весах, т. е. ±0,0002 г.
В ряде случаев высушивание проводят в вакууме, иногда при комнатной температуре в эксикаторе (или в вакуум-эксикаторе) над осушителем.
Описанный способ определения потери массы при высушивании является одним из наиболее распространенных методов контроля качества химических веществ. Он прост по выполнению, универсален и систематически используется (в разных вариантах) при анализе многих десятков и сотен лекарственных препаратов в контрольно-аналитических лабораториях.
Ниже в качестве примеров перечислены лишь некоторые лекарственные препараты (в основном субстанции), для которых определение потери массы при высушивании косвенным методом отгонки является одним из обязательных фармакопейных тестов (в скобках указаны температура (в градусах Цельсия) выдерживания до постоянной массы, в ряде случаев дополнительные условия, а также допустимая норма потери массы в процентах): адреналина гидротартрат (комнатная температура, в вакуум-эксикаторе над серной кислотой, потеря массы не более 0,5%), акрихин (105—110°, < 8), аминазин (100—105°, <0,5), анальгин (100—105°, <5,5), барбамил (100—105°, <1,5), винилин (90—95°, 4 часа, <15), витамин В2 — рибофлавин (100—105°, <1,5), витамин B6 — пиридоксина гидрохлорид (100—105°, <0,5), витамин B12 —цианкобаламин (в вакууме при 105° и 5 мм рт.ст., <12), гексанал (100—105°, <1), глюкоза (100—105°, <10), глютаминовая кислота (100—105°, <0,5), дегидрохолевая кислота (100—105°, <0,5), дегидрохолевой кислоты таблетки по 0,2 г (в вакууме при 110°и 15 мм рт. ст., <8,5), дибазол (70—80°, <1,5), димедрол (100—105°, <0,5), желатин медицинский (100—110°, <16), изониазид (100—105°, <0,5), кальция лактат (120°, <30), кодеин (100—105°, <6), кодеина фосфат (100—105°, <7,0), кодеина гидрохлорид (100—105°, <0,5), кофеин (80°, <0,5), ланолин безводный (100—105°, <1), мезатон (100—105°, <0,5), метилтестостерон (100—105°, <1), метионин (100— 105°, <0,5), нафтизин (100—105°, <0,5), никотинамид (100—105°, <0,5), никотиновая кислота (100—105°, <0,5), парацетамол (100—105°, <0,5), прегнин (100—105°, <0,5), преднизон (100—105°, <0,5), рутин (135°, 6— 9%), сарколизин (100—105°, <6), сульгин (100—105°, 5—8), тетрациклина гидрохлорид (60°, в вакууме при 5 мм рт. ст., 3 часа, <2), теобромин (100—105°, <0,5), теофиллин (100—105°, <9,5), фенацетин (100—105°, <0,5), фталазол (100—105°, <1.6), фтивазид (120°, <7), фурадонин (100—105°, <7,5), хинина дигидрохлорид (100—105°, <3), эфедрина гидрохлорид (100—105°, <0,5).
Приведенное выше впечатляющее число примеров позволяет судить о масштабе практического использования косвенных методов отгонки, разнообразии варьирования условий, примерном содержании летучих примесей в типичных лекарственных препаратах, подвергающихся анализу при контроле их качества.
Методы отгонки иногда применяют в сочетании с экстракцией. Определяемый компонент извлекают из водного раствора органическим экстрагентом (например, хлороформом) в органическую фазу, которую затем отделяют от водной фазы. Органический растворитель (экстрагент) отгоняют и взвешивают полученный сухой остаток. Так анализируют ряд лекарственных препаратов, например, хинина гидрохлорид, хинина дигидрохлорид, натриевые соли барбитуратов, тиопентал натрия и др.
Расчет оптимальной массы исходной навески в косвенном методе отгонки. В косвенном методе отгонки, который, как показано выше, широко применяется для определения содержания летучих веществ в анализируемом образце, при выборе оптимальной массы т исходной навески для анализа обычно исходят из того, чтобы относительная (процентная) ошибка определения не превышала ±0,2% при условии взвешивания образца на аналитических весах до и после потери массы. Массу т исходной навески берут такой, чтобы как масса удаляемых летучих веществ, так и масса остатка после их удаления была бы не менее 0,1 г. При этом условии минимальную массу т исходной навески рассчитывают по формуле (7.1):
m = m (X)×100%/W(X), (7.1)
где т(Х) — масса удаляемых летучих веществ X, равная ~ 0,1 г;
W(X) — массовая доля (в процентах) летучих веществ Х в навеске т, не превышающая ~ 50%; W(X) < 50%.
Приблизительное значение W(Х) должно быть известно.
Пример. Рассчитайте оптимальную массу т исходной навески пентагидрата сульфата меди(II) CuSO4 • 5H2O, которую необходимо взять для определения содержания воды в этом соединении косвенным методом отгонки.
Решение. Расчет массы т проводим по формуле (2.1):
т =m(H20) ×100%/W(H2O).
Согласно изложенному, m(H20) = 0,1 г. Найдем W(H2O):
W(H2O) = 5M(H2O)×100%/M(CuSO4 ×5H2O) = 5×18×100%/249,7= 36,04%.
Окончательно m = 0,1 •100%/36,04 = 0,2775 г.
Таким образом, оптимальная масса исходной навески не должна быть меньше ~ 0,28 г.
На практике иногда для определения потери массы летучих веществ в объектах, содержащих даже всего около 0,5% (массовая доля) удаляющихся при высушивании компонентов, берут навеску анализируемого образца с небольшой массой около ~ 1 г. Так поступают, например, в фармакопейном анализе при контроле качества лекарственных препаратов на содержание летучих примесей и влаги.
Оценим относительную (процентную) ошибку e такого определения. Величина ее определяется ошибкой взвешивания на аналитических весах (±0,0002 г для одного взвешивания), массой исходной навески т, взятой для анализа, и m(Х) примесей X, улетучивающихся при проведении анализа.
Навеска взвешивается на аналитических весах два раза — до и после потери массы. Следовательно, ошибка взвешивания на аналитических весах составляет Dm= ±(2 • 0,0002) = ±0,0004 г. Она равна, очевидно, абсолютной ошибке определения.
Если т = 1 г, то при содержании летучих веществ W(X) =0,5% величина m(Х) будет равна m(Х) = 1 • 0,5/100 = 0,0050 г. Следовательно, относительная ошибка определения e составит
e= Dm ×100%/m(Х)= 0,0004 ×100/0,0050 = 8,0 %
от массы летучих веществ, содержавшихся в анализируемом объекте.
Таким образом, при содержании летучих компонентов около 0,5% в навеске массой 1 г ошибка анализа составит около 8%, т. е. значительную величину.
При большей массе навески ошибка анализа уменьшается (см. выше).
Методы выделения. Определяемый компонент выделяют (обычно из раствора), например, при электролизе на одном из электродов (электрогравиметрический метод). Затем электрод с выделившимся веществом промывают, высушивают и взвешивают. По увеличению массы электрода с веществом находят массу выделившегося на электроде вещества. Так анализируют сплавы золота и меди: сплав переводят в раствор и после отделения золота определяют оставшуюся в растворе медь(II) электрогравиметрически.
Термогравиметрические методы. Эти методы основаны на измерении массы анализируемого вещества при его непрерывном нагревании в заданном температурном интервале (чаще всего от комнатной температуры до заданной). Измерения обычно проводят на специальных приборах — дериватографах, снабженных специальными термовесами непрерывного взвешивания, электропечью для нагревания образца, термопарами для измерения температуры, эталоном для сравнения и самописцем, который непрерывно записывает изменение массы нагреваемого вещества.
В типичном эксперименте навеску анализируемого вещества помещают в платиновый тигель (или тигель из другого материала), находящийся на термовесах непрерывного взвешивания внутри дериватографа, и нагревают тигель с содержимым с заданной скоростью повышения температуры. Изменение массы анализируемого образца автоматически фиксируется на бумаге самописцем в виде кривой изменения массы — термогравиграммы в координатах время (чаще всего) или температура (ось абсцисс) — потеря массы (ось ординат) — см. ниже рис. 7.1. Нагревание осуществляют либо на воздухе, либо в атмосфере инертного газа, например азота.
Большинство веществ при нагревании подвергаются тем или иным термическим превращениям — может происходить обезвоживание, плавление, изомеризация, разложение, окисление и т. д. в зависимости от природы вещества, температуры, состава атмосферы, в которой осуществляется нагревание. Эти термические превращения, как правило, происходят не непрерывно, а ступенчато, в очень узком температурном интервале, лишь при достижении некоторой температуры. Термические превращения часто сопровождаются изменением массы вещества (за исключением плавления, изомеризации и т. п. процессов, протекающих без изменения массы). Изменение массы анализируемого образца записывается самописцем в виде более или менее четкой ступени на термогравиграмме. Таких ступеней может быть несколько. По окончании эксперимента определяют изменение массы на каждой ступени термических превращений и интерпретируют природу термических эффектов — проводят расшифровку термогравиграмм. Очень часто таким путем определяют содержание воды и других составляющих в анализируемом веществе.
Обычно одновременно с записью термогравиграмм (кривые ТГ) самописец дериватографа фиксирует также кривую изменения температуры (кривую Т); кривую регистрации тепловых эффектов (эндотермических и экзотермических), которые сопровождают термические превращения как с изменением, так и без изменения массы (кривую ДТА — дифференциально-термического анализа, или просто термограмму), дифференциальную термогравиметрическую кривую изменения массы (кривую ДТГ); иногда фиксируются и некоторые другие кривые, характеризующие динамику термических превращений. В целом такое исследование называют термическим анализом (отметим, что в физической химии под термическим анализом подразумевают также получение термических кривых, по которым строят диаграммы плавкости).
При расшифровке термогравиграмм часто получают ИК-спектры поглощения исходного анализируемого вещества и продуктов его термических превращений. Вначале получают ИК-спектр поглощения исходного вещества, термограмму и термогравиграмму этого вещества, а также ИК-спектр поглощения конечного продукта термических превращений — остатка в тигле после завершения процесса нагревания и последующего охлаждения до комнатной температуры. По термограмме и термогравиграмме определяют наличие термоэффектов и соответствующие им температуры. Затем в отдельных экспериментах осуществляют нагревание исходного вещества до температуры того или иного зафиксированного на термограмме эффекта либо непосредственно в дериватографе, либо в термостате (в сушильном шкафу) до постоянной массы (при температуре данного термоэффекта), после чего остаток охлаждают до комнатной температуры и записывают его ИК-спектр поглощения. По полученным спектрам судят о том, какое вещество образуется на той или иной ступени термических превращений.
Термогравиметрические методы чаще всего используют для анализа неорганических и координационных соединений, например, для определения содержания воды, реже — в анализе органических веществ.
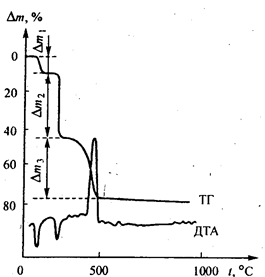
Рис. 7.1Термогравиграмма (ТГ) и термограмма (ДТА) салицилатного. комплекса цинка Zn(НОС6H4СОО)2 х 2Н2O; Dm,% ‑ потеря массы в процентах от исходной навески (100 мг) комплекса. Минимумы на кривой ДТА соответствуют эндотермическим термоэффектам, максимум — экзотермическому термоэффекту.
Пример. Термогравиметрический анализ салицилатного комплекса цинка состава Zn(НОС6H4СОО)2 × 2Н2O.При непрерывном нагревании этого соединения на воздухе от комнатной температуры до ~1000°С на термогравиграмме (рис. 2.1) фиксируются три эффекта потери массы — около ~-80—110 °C (эндотермический, максимальная потеря массы наблюдается около 90 °C), ~190—250 °C (эндотермический, максимальная потеря массы около ~230°С) и ~410—80 °C (экзотермический, максимальная потеря массы около ~460°С), при которых теряются соответственно Dm1 = 9,59%, Dm2 = 36,77% и Dm3 = 31,98% от массы исходного вещества. При дальнейшем нагревании выше 500 °C потеря массы уже не наблюдается.
Расшифровка термогравиграммы (кривая ТГ на рис. 2.1) и термограммы (кривая ДТА на рис. 2.1) с использованием ИК-спектров поглощения исходного комплекса и продуктов его термолиза показала, что при первом термоэффекте (~80—110 °C) исходное соединение обезвоживается:
Zn(НОС6H4СОО)2 ×2H2O ® Zn(НОС6H4СОО)2 + 2Н2O
При втором термоэффекте (~190—250 °C) теряется одна молекула салициловой кислоты:
Zn(НОС6H4СОО)2 ® Zn(ОС6H4СОО) + НОС6H4СООН
При третьем термоэффекте (~410—490 °C) происходит окислительное разложение (окисление — за счет кислорода воздуха) моносалицилата цинка, образовавшегося на второй стадии, с выделением диоксида углерода и паров воды; твердый остаток представляет собой чистый оксид цинка:
Zn(ОС6H4СОО) +7О2 ®ZnO+7CO2+2H2О
Отметим, что, как следует из вышеизложенного, в методах термогравиметрии определяемый компонент не отделяют из анализируемого образца, а исследуют сам анализируемый образец. Поэтому эти методы условно (и не всегда) включают в рассматриваемую классификацию гравиметрических методов анализа.
Метод осаждения
Метод осаждения — один из самых распространенных и основательно разработанных в гравиметрическом анализе.
