Галогенангидриды и ангидриды карбоновых кислот в организме не обнаружены.
КАРБОНОВЫЕ КИСЛОТЫ
КЛАССИФИКАЦИЯ
I. Алифатические кислоты
Насыщенные
Метановая (ИЮПАК), муравьиная (тривиальная), карбоновая
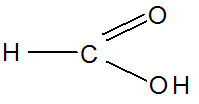
Этановая (ИЮПАК), уксусная (тривиальная), метилкарбоновая
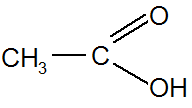
Ненасыщенные
Пропеновая (ИЮПАК), акриловая (тривиальная), винилкарбоновая
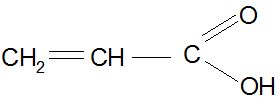
Алифатические кислоты, у которых число атомов углерода больше 6 называются жирными кислотами.
Пальмитиновая стеариновая олеиновая
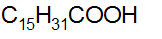
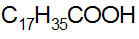
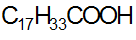
II. Алициклические
Циклопропанкарбоновая кислота
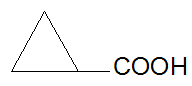
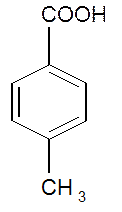
III. Ароматические
бензойная кислота n – толуиловая кислота
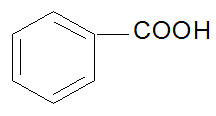
ФИЗИЧЕСКИЕ СВОЙСТВА
Монокарбоновые кислоты с С1 до С9 – бесцветные жидкости;
ароматические, высшие алифатические – твердые вещества.
Муравьиная, уксусная и пропионовая кислоты имеют резкий раздражающий запах, остальные кислоты с неприятным запахом.
Муравьиная, уксусная и пропионовая кислоты с водой смешиваются в любых соотношениях.
3 – 6% - ный раствор уксусной кислоты называется «столовым уксусом».
Чистая уксусная кислота – прозрачная жидкость с резким запахом; при 160С затвердевает, поэтому ее называют «ледяной» уксусной кислотой.
С увеличением углеродной цепи растворимость в воде уменьшается и возрастает гидрофобность.
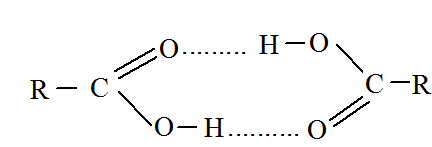
Температуры кипения монокарбоновых кислот выше температуры кипения соответствующих спиртов и альдегидов, что объясняется способностью кислот к ассоциации за счет водородных связей.
В твердом и жидком состоянии кислоты в результате возникновения водородных связей образуют устойчивые циклические димеры:
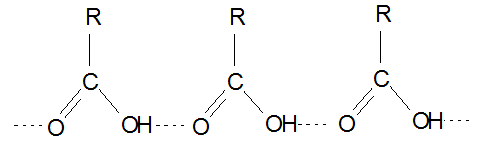
В водных растворах кислоты образуют ациклические димеры и олигомеры.
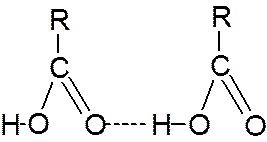
Строение карбоксильной группы
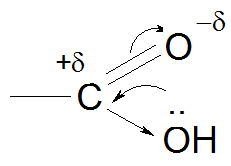
р,  - сопряженная система
- сопряженная система
Длина связи С=О – 0,118 – 0,126 нм
Длина связи С – О – 0,121 – 0,137 нм
Угол О – С – О – 118 – 1250С
ХИМИЧЕСКИЕ СВОЙСТВА
Реакционные центры
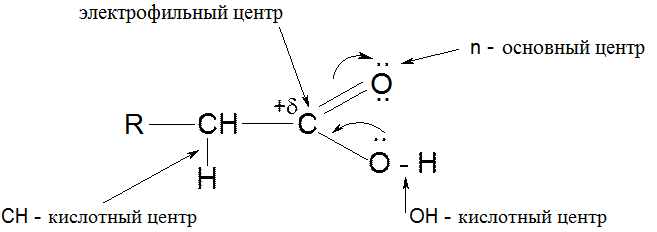
1. Кислотный характер карбоновых кислот:
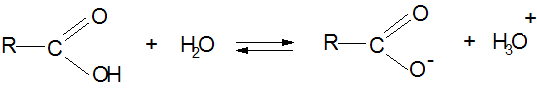
Стабильность карбоксилат-иона:
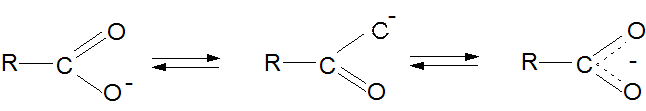
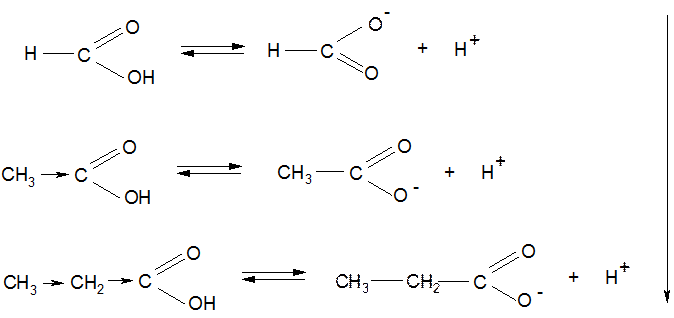
Влияние ЭД-ных заместителей на кислотные свойства:
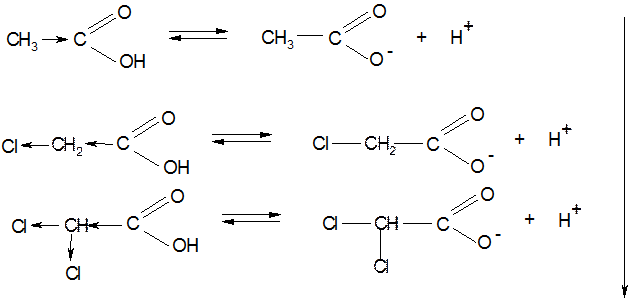
Влияние ЭА-ных заместителей на кислотные свойства:
Карбоновые кислоты образуют соли:
cоли кислот от С11 и выше называются мылами:
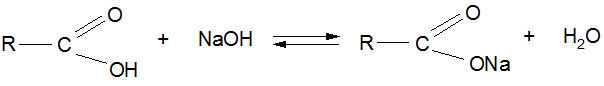
Основные свойства карбоновых кислот
3. Образование амидов:
R – COOH + NH3 → R – CONH2 + H2O
Амиды - кристаллические вещества (кроме формамида НСОNН2).
4. Образование галогенангидридов кислот с помощью РCl5, PCl3, SOCl2:
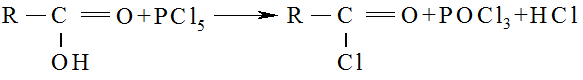
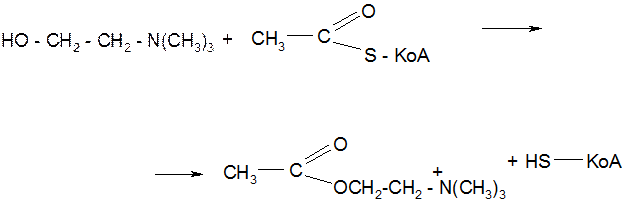
5. Реакция S – ацилирования тиолов
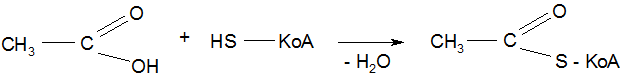

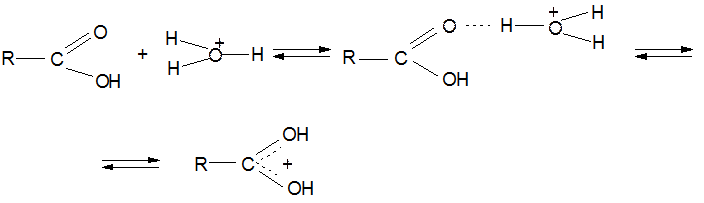
6. Реакция этерификации:
R – COOH + R1OH  R – COOR1 + H2O
R – COOR1 + H2O
Механизм реакции:
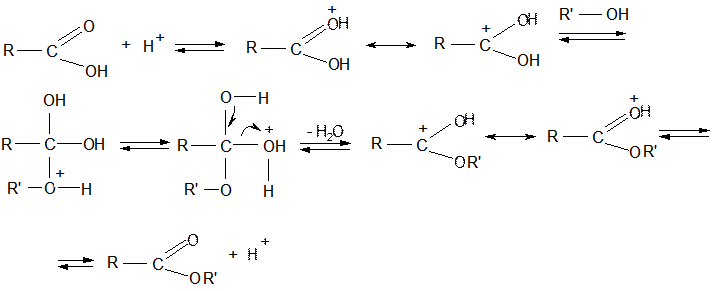
7. Образование ангидридов:
2R – C(О) – OH  R – C(О) – O – C(О) – R + H2O
R – C(О) – O – C(О) – R + H2O

Ангидриды кислот характеризуются большой активностью, являются ацилирующими агентами.
Среди производных карбоновых кислот в организме чаще всего встречаются их сложные эфиры, тиоэфиры и амиды.
Галогенангидриды и ангидриды карбоновых кислот в организме не обнаружены.
Производные карбоновых кислот склонны к взаимопревращениям за счет реакций нуклеофильного замещения:
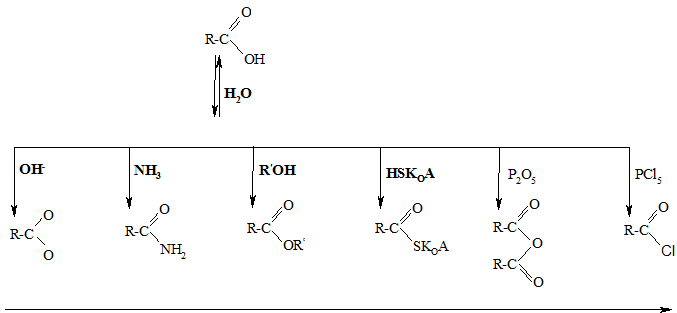
возрастание реакционной способности в процессах гидролиза
