Электрохимическая коррозия. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой
Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. M-ne> 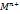 анодное окисление металла; Ox+ne>Red катодное восстановление окислителя.Электрох.кор.возн.вследствие короткозамкнутого гальванического элемента. Участки, где протекают катодные процессы, наз-сякатодными, другие анодными. ∆G<0 ∆E>0 ϕок>ϕвосст.
анодное окисление металла; Ox+ne>Red катодное восстановление окислителя.Электрох.кор.возн.вследствие короткозамкнутого гальванического элемента. Участки, где протекают катодные процессы, наз-сякатодными, другие анодными. ∆G<0 ∆E>0 ϕок>ϕвосст.
Скорость коррозии зависит от ее самой медленной стадии, называющей лимитирующей. Все остальные стадии вынужнены иметь скорость, равную скорости лимитирующей стадии. Большинство металлов может корродировать с поглощением кислорода, причем реакция катодного восстановления кислорода часто бывает лимитирующей стадией коррозии O2+2H2O+4e>4O 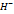 или О2+4
или О2+4 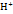 +4е>2Н2О. Максимальная скорость коррозии определяется предельной плотностью тока iпр восстановления кислорода по уравнению iпр=4F
+4е>2Н2О. Максимальная скорость коррозии определяется предельной плотностью тока iпр восстановления кислорода по уравнению iпр=4F 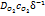 , где
, где 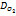 коэффициент диффузии кислорода,
коэффициент диффузии кислорода, 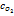 концентрация кислорода,
концентрация кислорода,  толщина диффузионного слоя. Также скорость процесса может определяться скоростью собственной реакции восстановления ионов водорода или соединением атомов водорода в молекулу. Иногда коррозия может контролироваться и анодными реакциями. Обычно это наблюдается на металлах, способных пассивироваться(пассивностью металла называется состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса). Коррозия пассивного металла согласно термодинамике возможна но практически не происходит из-за того, что анодное растворение его протекает крайне медленно.
толщина диффузионного слоя. Также скорость процесса может определяться скоростью собственной реакции восстановления ионов водорода или соединением атомов водорода в молекулу. Иногда коррозия может контролироваться и анодными реакциями. Обычно это наблюдается на металлах, способных пассивироваться(пассивностью металла называется состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса). Коррозия пассивного металла согласно термодинамике возможна но практически не происходит из-за того, что анодное растворение его протекает крайне медленно.
Бывает коррозия с водородной деполяризацией:
А:Ме-ze> 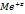 ; К: 2
; К: 2 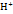 +2е>
+2е> 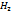 (pH<7); 2Н2О+2е>
(pH<7); 2Н2О+2е> 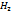 +2
+2 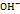 (рН>=7).
(рН>=7).
И с кислородной деполяризацией:
А: Ме-ze> 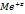 ;
; 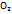 +4
+4 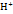 +4е>2Н2О (pH<7);
+4е>2Н2О (pH<7); 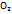 +2Н2О+4е>4
+2Н2О+4е>4 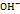 (рН>=7).
(рН>=7).
Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Рациональное конструировние: должно исключать наличие или сокращать число и размеры особо опансых, с точки зрения коррозии, участков в изделиях или конструкциях, а также предусматривать специальную защиту металла этих участков от коррозии. Протекторная защита: к изделию подсоединяют металл или сплав, потенциал которого значительнее отрицательнее потенциала металла изделия. В коррозионной среде металл протектора растворяется, а на изделии выделяется водород: 2H2O+2e>H2+2O 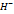 . Катодная защита: защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому она становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Вспом.электрод растворяется, а на защищаемом сооружении выделяется водород. При анодной защите защищаемый металл при растворении покрывается пассивной пленкой, например: 2Cr+2H2O-6e>Cr2O3+6
. Катодная защита: защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому она становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Вспом.электрод растворяется, а на защищаемом сооружении выделяется водород. При анодной защите защищаемый металл при растворении покрывается пассивной пленкой, например: 2Cr+2H2O-6e>Cr2O3+6 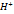 . Обработка среды: использование ингибиторов коррозии; уменьшение концентрации деполяризатора. Покрытия металлические: ими могут быть как чистые металлы, так и их сплавы. По характеру поведения можно разделить на катодные и анодные. Катодные: потенциал покрытия более положительное значение имеет, чем потенциал основного металла. Анодные покрытия имеют более отрицательный потенциал. Неметаллические покрытия: краски (алкидные, масляные и эмали), лаки (синтетические, битумные и дегтевые) и полимеры образуют защитную пленку на поверхности металлов, исключающую (при своей целостности) контакт с внешней средой и влагой.
. Обработка среды: использование ингибиторов коррозии; уменьшение концентрации деполяризатора. Покрытия металлические: ими могут быть как чистые металлы, так и их сплавы. По характеру поведения можно разделить на катодные и анодные. Катодные: потенциал покрытия более положительное значение имеет, чем потенциал основного металла. Анодные покрытия имеют более отрицательный потенциал. Неметаллические покрытия: краски (алкидные, масляные и эмали), лаки (синтетические, битумные и дегтевые) и полимеры образуют защитную пленку на поверхности металлов, исключающую (при своей целостности) контакт с внешней средой и влагой.
42.Cпособы защиты от коррозии,использование благородных металлов,сплавов,введение в поверхность металлических деталей дополнительных элементов.
Защита от коррозии:
1)Использование благородных металлов в создании сплавов
а)используются:Pt,Au,Ag, и др,
б)используется легирование-это введение в металл матрицы более коррозионно стойких металлов,т.е использование сплавов.
в)введение дополнительных элементов в поверхностные слои металла(азотирование,бромирование,имплантация)
Имплантация-в поверхность металла идут высокоэнергитические пучки Ce,Yb,La.30-5 кЭв,
