Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
В отличие от предыдущего случая с ростом температуры р-римость уменьшается. Закон В. Генри. При постоянной температуре р-римость газа, выраженная в весовых единицах пропорциональна давлению газа над жидкостью.
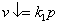 , где k-константа скорости растворения, p – давление газа над раствором.
, где k-константа скорости растворения, p – давление газа над раствором.
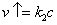 , где k-константа скорости испарения, c – концентрация.
, где k-константа скорости испарения, c – концентрация.
При достижении равновесия 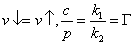 - константа Генри.
- константа Генри.
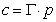 Концентрация пропорциональна давлению. Закон Сивертса:
Концентрация пропорциональна давлению. Закон Сивертса: 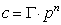 где n понижается с ростом температуры. Полностью закон Генри выполняется для идеальных газов, дающих в итоге идеальные р-ры.
где n понижается с ростом температуры. Полностью закон Генри выполняется для идеальных газов, дающих в итоге идеальные р-ры.
Закону Генри строго подчиняются только те газы, которые не взаимодействуют с р-рителем, их р-римость не велика. t=0, 100гр H2O р=1 атм, 0.335г CO2; р=2 атм, 0.67г CO2
С ростом давления увеличивается плотность газа, т.е. при р=2атм газ занимает тот же объем. Р-римость газа, выраженная в объемных ед. от объема не зависит (Объем. ед./100)
Закон Дальтона: При растворении смеси газов в жидкости р-римость каждого компонента пропорциональна его парциальному давлению. (Кислород в воде)
(кислород) t=20, 100мл Н2О, р=1атм, 3.1 мл O2
(воздух) t=20, 100мл Н2О, р=1атм, 0.62 мл O2
Законы Генри и Дальтона - следствия.
Закон распределения.
Если при постоянной температуре некоторое в-во распределяется между двумя соприкасающимися фазами, то отношение концентрации этого в-ва в соприкасающихся фазах есть величина постоянная, называется коэфф. растворения "L". Величина "L" не зависит от абс. кол-ва вводимого 3-го в-ва, а определяется природой фаз 1,2 и природой в-ва 3.
С/Р=Г Закон распределения применяется в технике. (при экстракции стали из шлака)
Закон распределения используется при глубокой очистке полупроводниковых материалов (метод плавки по закону распределения)
Законы Рауля.
Наблюдая св-ва р-ров Рауль пришел к выводу: Давление пара р-рителя над р-ром всегда ниже давления пара над чистым р-рителем. Вызвано это тем, что часть поверхности р-ра занята гидротированными частицами растворимого в-ва. Испарение раствор. затруднено.
Р0 - давление пара р-рителя над чистым р-рителем
Р1 - давление пара р-рителя над р-ром.
(дельта)Р=Р0-Р1 - абсолютное понижение давления пара р-рителя над р-ром.
(дельта)Р/Р0 - относительное понижение давления пара р-рителя над р-ром.
Р1=Р1*N1=P0*(n1/(n1+n2)
Р1 пропорц. мольной доле р-рителя в р-ре
Относительное понижение пара р-рителя над р-ром равно мольной доле растворенного в-ва: (дельта)Р/Р0=N2
Могут быть и отклонения от прямолинейной зависимости. По величине отклонения можно судить насколько система далека от идеального состояния. А по характеру отклонения "+" и "-" каков характер зависимости между компонентами в реальной системе. Т.к. давление пара раствора меньше, то р-ры должны кипеть при t более высокой, а замерзнуть при t менее низкой, чем чистые р-рители.
2 закон Рауля: Повышение температуры кипения р-ра и понижение температуры его замерзания пропорциональны молярной концентрации р-ра. 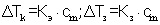 Кэ и Кз - константы, характеризующие р-ритель Кэ - эбуллиоскопическая Кз - криоскопическая (дельта)Т не зависит от природы р-ренного в-ва, а определяется природой р-рителя и числом молей р-ренного в-ва. Для Н2О Кэ=0.512, Кз=1.86
Кэ и Кз - константы, характеризующие р-ритель Кэ - эбуллиоскопическая Кз - криоскопическая (дельта)Т не зависит от природы р-ренного в-ва, а определяется природой р-рителя и числом молей р-ренного в-ва. Для Н2О Кэ=0.512, Кз=1.86
2 Закон Рауля используется для определения неизвестных молекулярных масс р-ренных веществ.
