Температура кипения и температура замерзания растворов. 2-й закон Рауля .
В прямой зависимости от давления насыщенного пара раствора нелетучего вещества находится температура кипения раствора.
Температурой кипения жидкости является температура, при которой давление ее паров становится равным внешнему давлению. А поскольку давление пара растворителя над раствором всегда меньше, чем над чистым растворителем, то и закипит раствор при более высокой температуре, чем чистый растворитель при равном внешнем давлении.
Повышение температуры кипения раствора не зависит от природы растворенного вещества, а определяется только концентрацией растворенного вещества и характером самого растворителя.
Математически эта зависимость выражается 2-м законом Рауля.
Обозначим:
DТкип - величина повышения температуры кипения раствора по сравнению с чистым растворителем.
DТкип = Ткип. р-ра – Ткип. р-рителя > 0
DТкип = Е × m, где
m – моляльная концентрация растворенного вещества, моль/1000 г р-рит.;
Е – эбуллиоскопическая константа.
Эбуллиоскопическая константа Е (от лат "ebullio" – вскипаю) – постоянная температуры кипения для каждого растворителя. Для наиболее распространенного растворителя – воды величина Е Н2О = 0,52.
Физический смысл эбуллиоскопической константы воды: при растворении в 1 кг воды 1 моль любого вещества температура кипения раствора повышается на 0,52 К.
Для удобства расчета DТкип раствора можно воспользоваться следующей формулой:
DТкип = 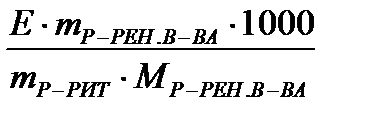 , где
, где
Е – эбуллиоскопическая константа растворителя К×кг/моль-1;
m р-рен.в-ва – масса растворенного вещества, кг или г;
m р-рит. – масса растворителя, кг или г;
Мр-рен. в-ва – молярная масса растворенного вещества, г/моль.
Понижение температуры замерзания раствора – коллигативное свойство, а, следовательно, не зависит от природы растворенного вещества, а только лишь от концентрации частиц в растворе.
Над твердым растворителем (для воды – это лед) всегда есть пары этого растворителя. Температура замерзания раствора – температура, при которой давление пара растворителя над раствором станет равным давлению пара над твердым растворителем при постоянном внешнем давлении. Давление пара над раствором всегда меньше, чем над чистым растворителем, поэтому раствор будет замерзать при более низкой температуре, чем чистый растворитель.
Математически эта зависимость также выражается 2-м законом
Рауля.
Обозначим:
DТзам. - величину понижения температуры замерзания раствора по сравнению с чистым растворителем.
DТзам. = Тзам. р-ра – Тзам. р-рителя < 0.
DТзам = К × m, где
m – моляльная концентрация растворенного вещества, моль/1000 г р-рит.;
К – криоскопическая константа.
Криоскопическая константа К(от греч. "krios" – холод) – постоянная температуры замерзания растворителя. Для водыКН2О = -1,86.
Физический смысл криоскопической константы аналогичен эбуллиоскопической константе: при растворении в 1 кг воды 1 моль любого вещества температура замерзания раствора понижается на 1,86 К.
Для расчета DТзам раствора удобно пользоваться следующей формулой:
DТзам = 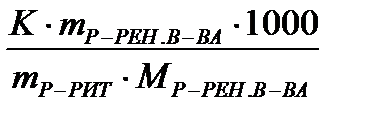 , где
, где
К – криоскопическая константа растворителя, К×кг/моль-1;
m р-рен.в-ва – масса растворенного вещества, кг или г;
m р-рит. – масса растворителя, кг или г;
Мр-рен. в-ва – молярная масса растворенного вещества, г/моль.
Формулировка 2-го закона Рауля: повышение температуры кипения и понижение температуры замерзания раствора прямо пропорционально числу частиц растворенного вещества и не зависит от его природы.
Это явление используется в технической практике, для чего применяются специальные добавки – антифризы, понижающие температуру замерзания водных растворов. Часто используют жидкие охладительные смеси, в частности, насыщенный раствор хлорида кальция СаСl2 не замерзает до температуры -550С. На этом же основано употребление соли для борьбы с гололедом.
(Все определения, формулы, графики даются под запись).
Многокомпонентные жидкие системы
На практике часто имеют дело со смесями растворителей, при этом компоненты находятся примерно в равном соотношении и все испаряются. Для расчета давления пара над растворами такого рода используют выражение закона Рауля для многокомпонентных систем:
Рр-р = Р10×N1 + Р20×N2 + Р30×N3 + …, где
Р0 - давление насыщенных паров чистых растворителей (1, 2, 3 и т.д.);
N – мольные доли компонентов в растворе.
В пожарно-технических расчетах часто приходится иметь дело как с индивидуальными жидкостями, так и со смесями пожароопасных веществ.
