Зависимость скорости реакции от концентрации
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
(по общей химической технологии)
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ.
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ
И ЭНЕРГИИ АКТИВАЦИИ
РЕАКЦИЙ
Кинетика химических реакций. Определение константы скорости и энергии активации реакций
Химические реакции подразделяют на гомогенные и гетерогенные реакции. К гомогенным реакциям относят реакции, у которых исходные вещества и продукты их взаимодействия находятся в одной и той же фазе − в газообразной или жидкой. Гетерогенными реакциями называют реакции, у которых реагирующие вещества находятся в различных фазах, а сам процесс химического превращения протекает на границе раздела этих фаз.
Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализатора. Однако эти факторы влияют на скорость гомогенных и гетерогенных реакций по-разному. Поэтому при изучении скорости реакции всегда учитывают различие между этими двумя типами химических процессов.
Зависимость скорости реакции от концентрации
Одним из факторов, влияющих на скорость большинства гомогенных реакций, может быть концентрация реагирующих веществ. С течением времени скорость химической реакции изменяется, так как изменяются концентрации реагирующих веществ. Поэтому различают среднюю и истинную скорости реакции.
О скорости химической реакции судят по количеству вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени. И чтобы это количество вещества было не произвольным, его относят к единице объема в случае гомогенных реакций или к единице поверхности раздела фаз для гетерогенных. Количество вещества в единице объёма это его концентрация (концентрацию принято выражать в молях на литр, а время — в минутах).
Поэтому средней скоростью реакции называют отношение уменьшения концентрации исходного вещества или увеличения концентрации продуктов реакции ко времени, в течение которого это увеличение или уменьшение происходило. Так, если концентрацию исходного вещества в момент времени t1 обозначить буквой С1, а концентрацию в момент времени t2 обозначить С2, то средняя скорость реакции 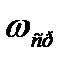 будет выражаться уравнением:
будет выражаться уравнением:
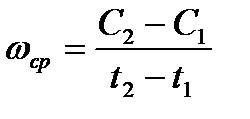
Истинной скоростью реакции называется изменение концентрации исходного вещества за бесконечно малый промежуток времени, что можно выразить следующим уравнением:
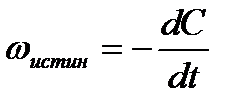
Знак минус «−» в правой части приведенного выше уравнения показывает, что концентрации реагирующих веществ уменьшаются, следовательно, и скорость химической реакции все время убывает.
Зависимость скорости химической реакции
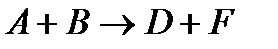
от концентрации реагирующего вещества можно выразить уравнением в соответствии с законом действующих масс:
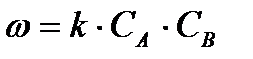
где СА и СВ — концентрации исходных веществ; к — коэффициент пропорциональности.
Коэффициент пропорциональности не зависит от концентрации реагирующих веществ, его называют константой скорости реакции. Величина константы скорости реакции зависит от природы реагирующих веществ, температуры и присутствия катализатора. Численное значение константы скорости реакции равно количеству вещества, прореагировавшего за единицу времени при концентрации исходных веществ, равных единице (например, 1 моль/л).
Константа скорости химической реакции показывает, какая доля из общего числа соударений молекул веществ А и В приводит к химическому взаимодействию. Если реакция осуществляется в результате столкновения молекулы А с молекулой В, то число столкновений, а следовательно, и скорость реакции будет пропорциональна концентрациям веществ А и В. Если для химического превращения необходимо, чтобы одновременно сталкивались по две или по три одинаковые молекулы, то скорость реакции будет пропорциональна квадрату или соответственно кубу концентрации этого вещества. По числу молекул, участвующих в каждом элементарном акте, реакции называются мономолекулярными, бимолекулярными, тримолекулярными и т. д.
Вполне понятно, что вероятность столкновения сразу трех и большего числа молекул меньше, чем вероятность столкновения двух молекул. Поэтому тримолекулярные реакции менее вероятны, чем бимолекулярные. Если в реакцию и вступает формально (в соответствии с уравнением) более трех молекул, то в действительности оказывается, что реакция проходит через ряд промежуточных стадий, в каждой из которых участвуют одна, две молекулы.
В зависимости от вида уравнения, связывающего скорость реакции с концентрацией реагирующих веществ, различают реакции нулевого, первого, второго и третьего порядка.
Если скорость реакции не зависит концентрации, то реакция имеет нулевой порядок; если скорость реакции зависит от концентрации в первой степени, то это реакция первого порядка; если - во второй, то второго порядка и так далее. В общем случае, например, для реакции
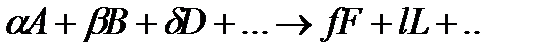
зависимость скорости от концентрации выражается кинетическим уравнением:
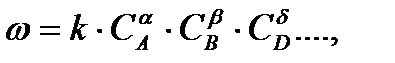
где показатели степени α, β, γ могут быть любыми небольшими числами, чаще всего равными 1 или 2, редко 3. Показатели степени концентрации определяются на основании экспериментальных данных. При некоторых условиях показатель может быть равным и нулю. Кроме того, известно немало реакций с дробными показателями.
Показатель степени концентрации реагирующего вещества в кинетическом уравнении реакции (α, β, γ) называется порядком реакции по данному веществу (А, В и D соответственно). Общим порядком химической реакции, или просто порядком реакции, называется величина, равная сумме показателей степени концентраций реагентов в кинетическом уравнении реакции,
Порядок реакции = а + β + γ + ....
Иногда показатель степени концентрации данного вещества в кинетическом уравнении совпадает с его стехиометрическим коэффициентом в уравнении реакции. Для элементарных реакций, т.е. реакций протекающих в одну стадию, показатели степени в кинетическом уравнении совпадают со стехиометрическими коэффициентами реагентов в уравнении реакции.
Если реакция протекает по нулевому порядку, то для нее
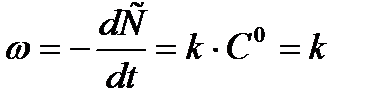 (1)
(1)
Перепишем выражение в виде
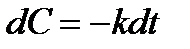
и возьмем неопределенный интеграл от обеих частей уравнения. Тогда
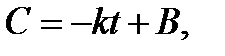
где В - постоянная интегрирования. В начальный момент времени t = 0, а концентрация С=С0. Подставляя эти значения получаем Со=В. Тогда концентрация реагирующего вещества в любой момент времени равна
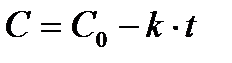 (2)
(2)
Следовательно, в реакциях нулевого порядка концентрация линейно уменьшается со временем (рис. 1а).
Константа скорости реакции нулевого порядка, исходя из последнего уравнения, вычисляется по формуле
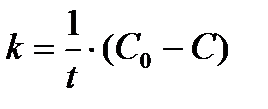 (3)
(3)
и имеет размерность 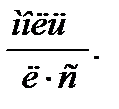
Наряду с константой скорости для характеристики реакций часто пользуются величиной, называемой временем полупревращения ( 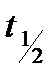 ) или периодом полупревращения. Период полупревращения- это промежуток времени, в течение которого половина взятого исходного количества вещества прореагировала. Если t =
) или периодом полупревращения. Период полупревращения- это промежуток времени, в течение которого половина взятого исходного количества вещества прореагировала. Если t = 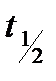 и С = С1/2, то подставляя в уравнение (2) получим
и С = С1/2, то подставляя в уравнение (2) получим
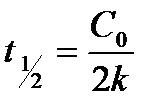 (4)
(4)
Кинетическое уравнение скорости первого порядка имеет вид
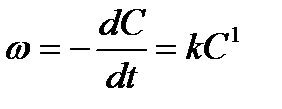
Разделим переменные (время и концентрация) и проинтегрируем:
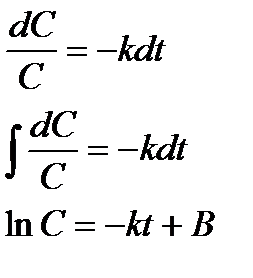
Считая, что в начальный момент времени t=0 концентрация исходного вещества равна С =С0, находим постоянную интегрирования В:
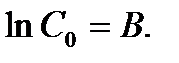
Откуда 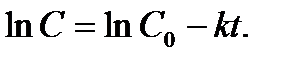 (5)
(5)
Следовательно, для реакции первого порядка характерна линейная зависимость логарифма концентрации от времени (рис. 1б), а константа скорости определяется выражением:
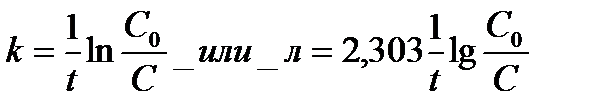 (6)
(6)
Константа скорости реакции первого порядка измеряется в с-1. Время полупревращения (часто говорят период полураспада) для реакций первого порядка равен (для t = t1/2 и С = Со /2)
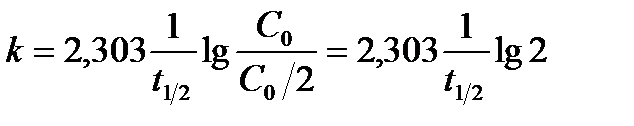
откуда
 (7)
(7)
Для реакций первого порядка период полупревращения не зависит от начальной концентрации исходного вещества, константа скорости обратно пропорциональна периоду полупревращения.
Для реакции второго порядка, считая концентрации исходных веществ равными, кинетическое уравнение запишется выражением:
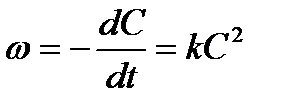
После разделения переменных, интегрирования и определения постоянной интегрирования получим:
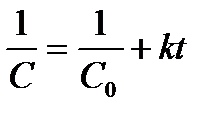 (8)
(8)
Откуда
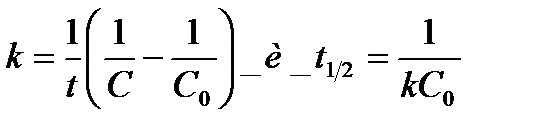 (9)
(9)
Константа скорости реакции второго порядка измеряется в 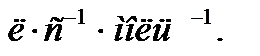
Рис. 1. Изменение концентрации со временем в реакциях:
а – нулевого порядка; б – первого порядка; в – второго порядка
Для реакций второго порядканаблюдается линейная зависимость величины обратной концентрации от времени (рис. 1в). В отличие от реакций первого порядка период полупревращения реакций второго порядка обратно пропорционален начальной концентрации.
Порядок реакции не всегда совпадает с молекулярностью. Так, для мономолекулярных реакций, т. е. таких реакций, при которых превращению подвергается только одна молекула какого-нибудь вещества, скорость реакции будет пропорциональна только его концентрации в данный момент, что можно выразить следующим уравнением:
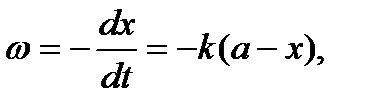 (10)
(10)
где а − начальная концентрация вещества; х − концентрация образующегося вещества. Следовательно, (а —х) представляет собой изменение концентрации исходного вещества за определенный промежуток времени.
После разделения переменных и интегрирования получается следующее уравнение константы скорости химической реакции первого порядка:
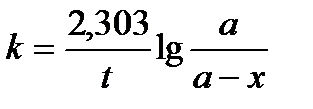 (11)
(11)
При вычислении правой части этого уравнения (в соответствии с экспериментальными данными для различных моментов времени t течения реакции), получим константу скорости реакции. Численные значения константы скорости окажутся одинаковыми в любой момент времени реакции.
Скорость бимолекулярной реакции пропорциональна произведению концентрации обоих реагирующих веществ. Следовательно,
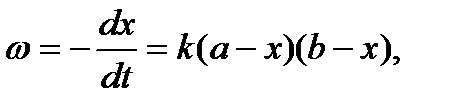
Здесь а и b - начальные концентрации веществ А и В соответственно; х - количество молей вещества, прореагировавшее за время t.
После соответствующих математических преобразований, как и в первом случае, получают окончательное уравнение для константы скорости реакции второго порядка:
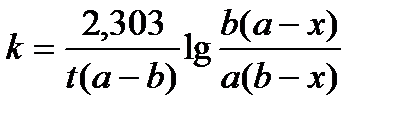 (12)
(12)
Если при бимолекулярной реакции концентрация одного из исходных веществ значительно больше концентрации другого вещества, то во время реакции концентрация вещества, взятого в избытке, остается практически постоянной. Поэтому можно объединить постоянную величину концентрации и константу скорости реакции в одну константу. Тогда получают выражение для скорости химической реакции, которое аналогично выражению для реакции первого порядка. И константу скорости реакции можно вычислить по уравнению (11) первого порядка.
Таким образом, константы скорости для бимолекулярных реакций, протекающих при наличии избытка одного из реагирующих веществ, вычисляют по уравнению для реакции первого порядка. Подобные реакции принято называть псевдомолекулярными.
Следует отметить, что большинство реакций протекает через промежуточные стадии и порядок реакции редко соответствует количеству молекул, вступающих в реакцию. Общая скорость сложной реакции определяется скоростью наиболее медленной её стадией.
