Полярографиялық анализ
Полярографиялық анализді ең алғаш чех ғалымы Ярослав Гейровский 1922 жылы ұсынған Полярографиялық анализде катод ретінде тамшылап тұрған сынап электроды қолданылады. Тамшылы сынап электроды дегеніміз сыртқы диаметрі 3–7мм, ішкі диаметрі – 0,05– 0,1мм болатын шыны капиллер арқылы алынатын Hg – тамшысы. Капиллярдан 2–7 сек аралығында сынап тамшылап ағып тұрады. Әрбір капиллярдың өзіне тән ерекшелігі, яғни сипаттамасы болады. Мысалы; 1) тамшылау жылдамдығы: m өлшем бірлігі, г/сек, яғни 1 секундта ағып өтетін Hg–тың мөлшері деген сөз; 2) тамшылау периоды: t, сек 10-15 тамшының пайда болып, үзіліп түсу уақытын анықтап, осыуақытты тамшы санына бөліп, тамшылау периодын анықтайды. Тамшылау периоды ерітіндінің потенциалына байнанысты болады. Сынап тамшысының массасын (10-15 тамшысы) аққан уақытына бөліп, сынаптың тамшылау жылдамдығын анықтайды.
Басқа электродтарға қарағанда, тамшылы сынап электродының бірқатар ерекшеліктері бар:
1) Сынаптың тамшылап тұруы электрохимиялық процестің үнемі жаңарып тұратын таза электрод бетінде жүруін қамтамасыз етеді.
2) Сынап электродында H2 жоғары кернеумен бөлінеді, сол себепті сынап электродында электртерістігі жоғары металдарды анықтауға және олардың қасиеттерін зерттеуге болады.
3) Сынап электродына оң потенциалды да беруге болады. Сынаптың тотығу потенциалы ерітінді табиғатына байналысты +0,4В жуық болады. Яғни сынап электродында кейбір тотығу және көптеген тотықсыздану реакцияларын зерттеуге болады.
4) Анықталатын зат электродта өте аз мөлшерде тотықсызданады да, оның ерітінді көлеміндегі концентрациясы өзгермейді десе де болады. Сондықтан бір ерітіндіден бірнеше (ондаған) полярографиялық толқынды алуға болады.
Сонымен, сулы ерітінділерде тамшылы сынап электродын +0,4 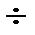 -2,6В потенциал аралығында электрохимиялық процестерді зерттеуге болады.
-2,6В потенциал аралығында электрохимиялық процестерді зерттеуге болады.
Осы айтылғандардан, сынап электродының ешқандай кемшілігі жоқ екен деп ойлап қалуға болмайды. Сынап, электродының мынадай кемшіліктері де бар: 1) Оң потенциалдың жоғары мәнінде Hg – тотығуы байқалады;2) Hg – электродында электродтық процестерді жоғары температурада зерттеуге болмайды, яғни зерттеуді 80о-тан төмен температурада ғана жүргізуге болады.
Полярографиялық анализде вольтамперлік қисықтар алынады. Сондықтан полярографиялық анализді вольтамперометриялық әдістің бір түрі ретінде қарастырады.
14.43-суретте полярографиялық құрылғының ринципиальды сызбасы мен қарапайым полряографиялық ұяшық берілген.
Электродтарға сырттан берілетін кернеу катодты және анодты полеризациялауға жұмсалады:
E = Ea – Ek + iR
бұндағы iR – ерітінді кедергісі, Еа – анодты, Ек – катодты потенциал.
Полярографияда қолданылатын бір электрод поляризацияланбайтын болғандықтан, оның потенциалы тұрақты болады.
E = const – Ek + iR немесе E = Eа – const + iR.
| N2 |
| Hg |
| N2 |
| V |
| r |
| C |
| Б |
| А |
| ЭЯ |
| Е |
а) б)
14.43-сурет. Полярографиялық құрылғының принципиальды сызбасы (а) және қарапайым полярографиялық ұяшық (б):
а) ЭҰ – электролиттік ұяшық; Е – тұрақты ток көзі; АБ – калибрленген кедергі; С –тұйықтағыш; V – вольтметр; Г – гальванометр.
б) 1. шыны капилляр; 2. полиэтилен түтік; 3. сынап құйылған резервуар; 4. газ үрлейтін түтік; 5. ерітіндіні ауыстыратын воронка; 6. ыдыс түбіне құйылған сынап.
Индикаторлы электродта пайда болатын токтың мөлшері 10–6 – 10–5А шамасында болады. Ерітінді кедергісін iR күшті электролиттер қосып азайтуға болады. iR – дің мәні өте аз шама, ол 10–3 – 10–2 сәйкес болады. Сондықтан оны ескермеуге де болады. Олай болса, Е=const–Ek немесе Е= Eа– const, яғни сырттан беретін кернеу тек қатодтың немесе анодтың потенциалын өзгертуге кетеді.
Полярографиялық «ток – потенциал» қисығын алу үшін индикаторлы электродқа берілген потенциалды өзгерте отырып, токтың өзгеруін гальванометрді қолданып бақылайды. Ток күші мен потенциалдың арасындағы байланысты көрсететін полярографиялық қисықты вольтамперлік немесе поляризациялық қисық, полярограмма немесе полярографиялық толқын деп атайды (14.43-сурет). Оның жалпы түрі мынадай болады. Алғашында кернеуді қосқанда жүйеден ток өтпейді: ОА бөлігі.
Екінші электродпен салыстырғандағы анықтайтын заттың тотықсыздану потенциалының мәніне жеткенде ток өсе бастайды (АВ бөлігі). Потенциалды одан әрі өзгерткенде, ток алғашында өседі де, содан соң тұрақты болып қалады (ВС).
| I Д |
| С |
| В |
| О |
| А |
| E1/2 |
| – E, В |
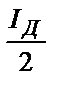 |
| I, мкА |
14.43-сурет.
Полярограмма және
оның сипаттамалары
Қалдық ток. Полярографиялық қисықтың ОА – бөлігін қалдық ток деп атайды. Бұл бөлікте анықтайтын зат электрохимиялық реакцияға қатыспайды, пайда болған токтың мәні өте аз. Қалдық ток екі құрамнан тұрады. Біріншісі – ерітіндіде берілген потенциалдарда тотықсызданатын қоспалармен анықталатын Фарадей тогы. Өте таза ерітінділерде де жүретін қоспаның бірі – еріген оттегі. Ауамен қаныққан ерітіндідегі оттегінің мөлшері ~ 2,5·10–4 моль/л болады. Оттегі тамшылы сынап катодында екі сатымен тотықсызданады. Бірінші сатысы асқын тотыққа дейін тотықсыздану:
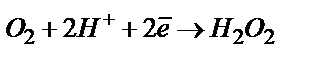 (қышқыл ортада)
(қышқыл ортада)
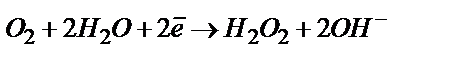 (нейтралды не сілтілі ортада).
(нейтралды не сілтілі ортада).
Екінші сатысы асқын тотықтың су не гидроксид ионына дейін тотықсыздануы:
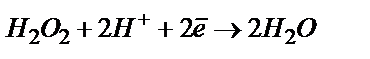 (қышқыл ортада)
(қышқыл ортада)
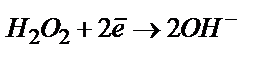 (сілтілі ортада)
(сілтілі ортада)
Оттегінің тотықсыздануы нәтижесінде 2-полярографиялық толқын пайда болады, біріншісі +0,1  0,0В, екіншісі –0,9
0,0В, екіншісі –0,9  –1,0В те басталады (14.44-сурет). Анықтайтын зат иондарына сәйкес дұрыс полярографиялық толқын алу үшін ерітіндідегі оттегін жою керек. Ол үшін ерітіндіден 10–15 минуттай инертті газ жіберіп (азот, агрон, гелий) үрлейді.
–1,0В те басталады (14.44-сурет). Анықтайтын зат иондарына сәйкес дұрыс полярографиялық толқын алу үшін ерітіндідегі оттегін жою керек. Ол үшін ерітіндіден 10–15 минуттай инертті газ жіберіп (азот, агрон, гелий) үрлейді.
| 1,9 |
| 1,5 |
| 1,1 |
| 0,7 |
| 0,3 |
| - E, B |
| I, MкА |
14.44-сурет
Егер ерітінді ортасы нейтралды не сілтілі болса, ерітіндіге қатты сульфит салып, О2 – байланыстыруға болады. 2Na2SO3+O2®2Na2SO4. 100 мл ерітіндіге салынған 0,1 г Na2SO3 5 минут ішінде О2 – толық жояды. Қалдық токтың екінші құрамы конденсаторлы ток. Бұл қос электрлік қабатты зарядтауға кететін ток, яғни үнемі жаңарып тұратын сынап электродының бетінде қос электрлік қабатын құруға жұмсалатын зарядталған иондар электродтың беткі қабатында разрядталмайды. Олар тек қос электрлік қабатын не конденсаторды түзеді. Электродқа беретін теріс потенциал артқанда конденсаторлы токтың да мәні артады. Сонымен қалдық тоғы ir; Фарадей тогы – if және конденсаторлы – іс токтардан тұрады: ir= if+ic.
Қалдық токтың мәні 10–7А шамасында болады, сондықтан анықтайтын заттың концентрациясы аз болса (~10–5моль/л) бұл токты еске алу керек.
Қаныққан ток. Полярографияда анықтайтын заттың концентрациясын қаныққан токтың мәнін өлшеп табады. Полярографиялық қисықта қаныққан ток электродтың беткі қабатына иондардың келу жылдамдығы оның тотықсыздану жылдамдығына теңескенде пайда болады. Электродтың беткі қабатына қанша ион келсе, сонша ион толық тотықсызданып кетеді. Қаныққан токты сандық анализде пайдалану үшін оның мәні анықталатын заттың концентрациясына тікелей тәуелді болу керек: In=KC. Мұндай жағдайды таңдап алу үшін анықтайтын бөлшектердің электродтың бетіне қандай күштердің әсерінен келетінін қарастыру қажет. Негізінде ондай үш күшті қарастыруға болады: 1) Миграция – иондардың электродқа электростатикалық күш нәтижесінде тартылуы. Электродқа оған қарама-қарсы зарядталған кез келген иондар тартылады. Миграция күшін жою үшін анықтайтын ерітіндіге көп мөлшерде (~ 100 есе артық) индифферентті электролит құяды. Мұндай электролитті полярографияда фон деп атайды. Егер электродтың бетіне тартылған иондар берілген потенциалда разрядталмаса (индифферентті) оның электродтың зарядына сәйкес мөлшері электродтың бетінде қалады да, басқа иондар әрмен қарай ерітіндіден электродқа тартылмайды. Сондықтан фон қатысында анықтайтын иондардың электродқа миграция күші нәтижесінде тартылуы болмайды. 2) Конвекция – иондардың электродқа араласу күшінің нәтижесінде келуі. Бұл күшті жою үшін полярографияда ерітіндіні араластырмай және tо–ны тұрақты етіп ұстайды. 3) Диффузия – иондардың электродқа концентрациялардың айырымы нәтижесінде келуі. Диффузия жылдамдығы анықтайтын ионның ерітіндідегі (С) және электродтың беткі қабатындағы (Со) концентрациялар айырымына тікелей пропорционалды, яғни диффузия жылдамдығы ≈ 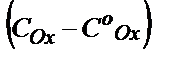 .
.
Полярографияда миграция және конвекция күштері жойылатындықтан, иондар электродтың беткі қабатына тек диффузия күші нәтижесінде келеді, бұл біріншіден. Екіншіден 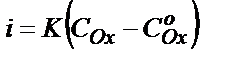 екені белгілі. Қаныққан токқа жеткенде
екені белгілі. Қаныққан токқа жеткенде 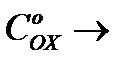 О-ге ұмтылады, яғни I=KCOх. Бұдан қаныққан диффузиялы токтың мәні разрядталатын бөлшектердің ерітіндідегі концентрациясына пропорциональды екенін көруге болады.
О-ге ұмтылады, яғни I=KCOх. Бұдан қаныққан диффузиялы токтың мәні разрядталатын бөлшектердің ерітіндідегі концентрациясына пропорциональды екенін көруге болады.
Диффузиялық токтың мәні сынап тамшысының массасына және бір тамшының пайда болу уақытына байланысты болады. Бұл байланысты Илькович теңдігі арқылы көрсетсек:
I =605 · n · D 1/2 · m 2/3 · t 1/6 · COх.
Бұндағы: I – қаныққан диффузиялық ток; С – электрактивті бөлшектің концентрациясы, ммоль/л; n – электрохимиялық реакцияға қатысатын электрондар саны. D – анықтайтын бөлшектің диффузиялық коэффициенті, см2/сек; m – сынап тамшысының массасы, мг/с; t – бір тамшының пайда болу уақыты, с; m 2/3·t 1/6 – капиллярдың сипаттамасы. Илькович теңдігінен қаныққан токтың капиллярдың сипаттамасына тікелей тәуелді екенін көруге болады. Яғни капиллярдың сипаттамасы өзгерсе қаныққан токтың мәні де өзгереді. Диффузиялық коэффициенттің мәні ерітінді құрамына байланысты болады. Ерітінді құрамы өзгерсе, оның тұтқырлығы және диффузияға ұшырайтын бөлшектердің құрамы өзгереді.
Сондықтан полярографиялық анализде қаныққан токтың мәні тек қана анықтайтын бөлшектердің концентрациясына тәуелді болуы үшін диффузиялық коэффициент пен капиллярдың сипаттамасы өзгермейтін жағдай жасау қажет. Кей жағдайда вольтамперлік қисықтың қаныққан токқа ауысқан жерінде токтың күрт өсуі байқалады, бұны полярографиялық максимум деп атайды (14.45-сурет).
Полярографиялық максимумның пайда болу себебі ретінде:
- сынаптың беті біркелкі поляризацияланбауын;
- сынап тамшысы айналасындағы ерітіндінің тамшы қозғалысына байланысты араласуын (яғни анықтайтын ионның электрод бетіне келу жылдамдығының артуын) айтуға болады.
| - E, B |
| I, MкА |
Полярографиялық максимумды жою үшін ерітіндіге органикалық беттік активті заттардың (БАЗ) аз мөлшерін қосады. Мысалы: желатин, агар-агар, столярлы клей, тағы басқалары.
