Распространение в природе и получение. Соединения ванадия широко распространенны в природе, но они очень рассеянны и не образуют значительных скоплений (см
Соединения ванадия широко распространенны в природе, но они очень рассеянны и не образуют значительных скоплений (см. табл.3.6.). Ниобий и тантал встречаются всегда вместе, содержание их в земной коре еще меньше. Основные минералы: ванадит 3Pb3(VO4)2×PbCL2, колумбит-(Fe,Mn)NbO3×TaO3, лопарит (Nа,Са)NbO3×TaO3, танталит Fe(TaO3)2.
Главным источником ванадия являются железные руды, в которых его содержание составляет 0,1-0,2 %. Поэтому в доменном процессе ванадий значительно переходит в чугун. В производстве стали из ванадистого чугуна получают шлаки, содержащие ортованадат натрия NаVO3:
4FeVO4 + 4NaCL + O2 = 4NaVO3 + 2Fe2O3 + 2CL2
Действуя на ванадат натрия разбавленной серной кислотой выделяют оксид ванадия V2О5. Из оксида ванадий восстанавливают алюминием.
Металлы подгруппы ванадия получают:
- металлотермическим восстановлением (Са, AL) оксидов:
3V2O5 + 10AL  6 V + 5AL2O3
6 V + 5AL2O3
- металлотермическим восстановлением галогенидов или комплексных фторидов:
NbCI5 + 5Nа  2 Nb + 5 NaCI
2 Nb + 5 NaCI
K2[TaF7] + 5Nа  Ta + 5 NaF + 2 KF
Ta + 5 NaF + 2 KF
- электролизом Ме2О5 в расплаве K2[МеF7]
- алюмотермическим восстановлением смеси оксидов этих металлов с оксидами Fе. Получают сплавы феррованадий, ферротантал, которые используют как легирующие добавки к сталям.
Физические свойства
В виде простых веществ V, Nb, Ta- серые, тугоплавкие металлы (табл.3.6.) Физико-химические свойства этих металлов существенно зависят от чистоты: в чистом виде они легко поддаются механической обработке, а при загрязнении (Н2,О2,N2,С) становятся твердыми и хрупкими.
Таблица 3.6 .
Некоторые свойства элементов подгруппы ванадия
| Металл | Rат, нм | Плотность, г/см3 | Стандартный электродный потенциал, В | Jион., эВ | Tпл.,0C | Tкип.,0C | Содержание в земной коре, % |
| V | 0,134 | 5,96 | -0,835 Э3+/ Э -1,18 Э2+/ Э | 6,74 | 1,5×10- 2 | ||
| Nb | 0,145 | 8,58 | -1,099 Э3+/ Э | 6,88 | 1,5×10- 3 | ||
| Ta | 0,146 | 16,69 | - | 7,89 | 2×10- 4 |
Вследствие «лантаноидного сжатия» атомные и ионные радиусы Nb и Ta практически одинаковые, поэтому Nb и Ta очень близки по свойствам.
Рост по группе первого потенциала ионизации свидетельствует об уменьшении химической активности в ряду: V-Nb -Ta.
Химические свойства
В обычных условиях эти металлы, а особенно Nb, Ta отличаются высокой химической стойкостью.
Отношение к неметаллам схематично можно представить в виде схемы:
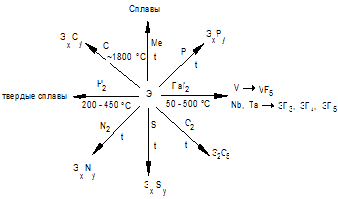
Металлы устойчивы на воздухе, но при нагревании взаимодействуют с О2, N2, С, галогенами, S с образованием соединений:VF5; VCI4; VBr3; NbHaI5 ; V2S3; VN; NbC.
Особую группу соединений представляют гидриды: ЭН, нитриды: ЭN, Nb2N, Ta2N, карбиды:ЭС, Э2С, бориды : ЭВ,ЭВ2. Кислород, при небольшом относительном содержании может образовывать фазы внедрения: Та6О, Та2О, Nb2О, Nb6О. Все это металлоподобные соединения (металлиды), обладающие электропроводностью, твердостью, тугоплавки, коррозиционно стойки. Так, Тплав. ТаС= 38800С. Служат они для создания жаропрочных сталей и сплавов, отличающихся высокой твердостью и химической инертностью.
Отношение к кислотам. В воде эти металлы устойчивы несмотря на то, что Е0 = -1,88 ¸ - 1,1 в, т.к. покрыты защитной оксидной пленкой:
переход V / V2+ V/ V3+ VO2+/V Nb/ Nb5+ Та/Та5+
E0298, В -1,17 -0,255 -0,25 -0,65 -0,75
Все металлы растворяются в плавиковой HF, смесях кислот:HF + HNO3 и HCI+ HNO3:
2V + 6HF ® 2 VF3 + 3 H2
3Nb + 21 HF + 5HNO3 ® 3H2[NbF7] + 5NO +10H2O
Ванадий взаимодействует с конц. H2SO4 и HNO3:
3V + 5 HNO3(конц) ® 3 HVО3 + 5NO + H2O
V + 4 H2SO4(конц) ® VОSO4 + SO2 + 3H2O
Схематично эти процессы можно представить в виде схемы:

Растворы щелочей на эти металлы почти не действуют, но в расплавах NaOH и KOH в присутствии О2 они растворяются с образованием ванадатов, ниобатов, гафнатов, например:
4Э + 12КОН + 5O2 ® 4К3ЭО4 + 6H2O
Следует отметить, что V вытесняет благородные металлы из растворов их солей, например
V + PtCI4 + H2O = VOCI2 + Pt + 2HCI;
или
4 FeCI3 + V + H2O = VOCI2 + 4FeCI2 + 2HCI.
т.е. восстанавливает: Fe+3 ® Fe+2 ; Cu+2 ® Cu +1 ; Hg+2 ® Hg2+2 и т. д.
Cоединения металлов
В ряду V—Nb—Ta устойчивость соединений в высшей степени окисления возрастает, а в низшей падает. Так для V+5 известны лишь V2O5 и VF5, а для Nb+5—Ta+5 – все галиды. Для ванадия более устойчива степень окисления +4.
Оксидыв высшей степени окисления образуются при окислении металлов кислородом. В отличие от ниобия и тантала, ванадий при этом образует VO2. Оксид ванадия (V) может быть получен при термическом нагреве ванадата аммония:
2NH4VO3 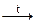 V2O5 + 2NH3 + H2O
V2O5 + 2NH3 + H2O
Оксиды металлов (V) тугоплавкие (кроме V2O5), твердые вещества, нерастворимые в воде. Все они амфотерны, с уменьшением кислотных свойств от V2O5 до Ta2O5 .
Оксид V2O5 Nb2O5 Ta2O5
Т.пл.,0С 670 1490 1870
цвет красно- белый белый
оранжевый
усиление основных свойств
 |
Оксид ванадия (V) при растворении в воде (0,007г/л при 25 0С) образует кислый раствор светло-желтого цвета, за счет образования слабых ванадиевых кислот: мета-НVО3, орто- Н3VО4, ди- Н4V2О7 ванадиевых кислот (сходство с фосфором).
V2О5 довольно легко растворим в щелочах с образованием ванадатов: К3VО4 или пированадатов К4V2О7:
V2О5 +2 КОН = КVО3 + H2O
метаванадат
при длительном нагревании растворим в кислотах с образованием оксосолей:
V2O5 + 2HCI(разб) ® [VО2]2CI + H2O
хлорид диоксованадила (V)
Оксиды ниобия Nb2O5 и тантала Ta2O5 химически инертны, в воде и кислотах (кроме НF) не растворяются, а реагируют со щелочами только при сплавлении:
Nb 2O5 + NaOH 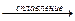 2Na3NbО4 + 3H2O
2Na3NbО4 + 3H2O
Для ванадия известны оксиды в более низких степенях окисления:
VО - V2О3 - VО2 -V2О5
серый черный синий красно-оранж.
 |  |  |
основ. амфот. кислот.
усиление кислотных свойств
 |
Оксиды ванадия (II) и (III) растворяются в кислотах, образуя гексааквакомплексы [V(H2O)6]2+ фиолетового цвета и зеленого- [V(H2O)6]3+ цвета.
VО2 при нагревании легко растворяется в кислотах, образуя соли ванадила VO+2:
VО2 + 2H2SO4 ® V(SO4)2 + 2H2O
V(SO4)2 + H2O® VОSO4 + H2SO4
сульфат ванадила
Кислотные свойства VО2 выражены значительно слабее. При взаимодействии с щелочами образуются соли ванадия (VI)- гипованадиты разного состава: К2VО3 , К2V4О9, где К2V4О9- соли поливанадистой кислоты:
VО2 + 2 КОН = К2VО3 + H2O
VО2 более устойчив в кислой среде, чем V2О5.
Гидроксиды.Действием щелочи на водные растворы соответствующих солей получают V(OH)2– (корич.) и V(OH)3 –(зелен.), например:
VCL2 + 2 NaOH = V(OH)2¯ + 2 NaCL
Гидроксид ванадия VO(OH)2 амфотерен, в растворе может диссоциировать по типу кислоты и основания:

 VО+2 + 2OH-↔ VО(OH)2↔ H2VO3 ↔ 2H+ + VO32-
VО+2 + 2OH-↔ VО(OH)2↔ H2VO3 ↔ 2H+ + VO32-
кислая щелочная
Степени окисления (V) соответствуют несколько кислот, как правило, неустойчивых в свободном состоянии. Они обычно представляют собой гидратированные оксиды типа nЭ2O5· xH2O. Наиболее известны мета- и орто- кислоты - НЭO3и Н3ЭO4.
Для ванадия известны три кислоты:
НVO3- метаванадиевая (Н3VO4 = НVO3 + H2O),
Н3VO4- ортованадиевая (3H2O·V2O5 = Н6V2O8= 2Н3VO4),
Н4V2O7- пированадиевая (диванадиевая Н6V2O8= Н4V2O7 + H2O).
В отличие от кислот фосфора, для которого наиболее устойчивой является ортофосфорная кислота, для ванадия наиболее устойчива метаванадиевая НVO3, которая относится к слабым кислотам (Кд = 1×10-4). Вероятность ее диссоциации по кислотному и основному типу примерно одинакова:
Н+ + VO3- ↔ НVO3↔ VO2ОН ↔ VO2+ + ОН-
 | |||
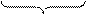 | |||
щелочные растворы кислые растворы
Растворы солей метаванадиевой кислоты имеют светло-желтую окраску, за счет тримеризации метаванадат ионов:
3VО3-ÛV3О93-
В кислых растворах протекает дальнейшее усложнение состава с образованием изополикислот- гексаванадат-ионов, что сопровождается углублением окраски от золотисто-желтой до рубино-красной:
2V3О93- + 2Н+ Û Н2О + V6О174-
или
2V3О93- + 4Н+ Û Н2О + V6О162-
Изополикислоты состава хV2O5 у H2O. Так при х = 5, у=3 образуется декаванадиевая кислота Н6V10O28. Поликислоты образуются в результате конденсации монокислот: две или несколько молекул монокислот при взаимодействии отщепляют воду с образованием нового соединения, например/1/:
2Н2CrO4 -H2O = Н2Cr2O7 или 10НVO3 -2H2O = Н6V10O28
Переход от метаванадатов к декаванадатов связан с рН среды и описывается уравнением:
10 VO3- 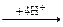 V10O286- + 2H2O
V10O286- + 2H2O

или в молекулярной форме:
10NH4VO3 + 5H2SO4 = Н6V10O28 + 5(NH4)2SO4 + 2H2O
Соли.Известны галогениды – ЭНа15. Это легкоплавкие летучие соединения, легко гидролизуемые водой с получением аморфных осадков гидратированных оксидов:
VF5 + 2 H2O = VOF3 + 2HF
или
2VOF3 + 3H2O = V2O5 + 6НF
Степень гидролиза увеличивается от галогенидов Та к галогенидам V, т.к. в этом направлении усиливаются кислотные свойства.
Галогениды склонны к образованию устойчивых комплексных соединений:
NbF5 + КF = K[NbF6] или TaF5 + 2КF = K[NbF7]
При гидролизе соединений ванадия (IV) мгновенно образуются оксосоли:
VCL4 + 2H2O = VOCL2 + 2HCL
так как в кислой среде устойчив катион V+4, в щелочной – анионы VO32-, в нейтральной среде VО2+.
Соли ванадила можно получить восстановлением соединений ванадия (V):
2КVО3 + 2SO2 + 2H2SO4 ® 2VОSO4 + К2SO4 + 2H2O
Наиболее изучен V2S5, который получают: V2S3 + 2 S = V2S5. Он проявляет кислотные свойства: растворим в основных сульфидах с образованием тиосолей:
V2S5 + 3Na2S = 2Na2VS4
кисл. основ. тиованадат
а также в полисульфидах:
V2S5 + 3(NH4)2S2 = 2(NH4)3VS4 + 3S
Соответствующая тиованадиевая кислота (Н3VS4 или НVS3)- неустойчива, поэтому разлагается в момент получения:
2 (NH4)3VS4 + 6HCI = 2H3VS4 + NH4CI.
¯ ¯
V2S5 3H2S
Сульфиды ванадия растворимы в кислотах:
3V2S5 + 16 HNO3(разб) = 6VO2NO3 +10NO + 15S + 8H2O
и щелочах:
V2S5 + 16 NaOH = 2Na3VO4 + 5Na2S + 8H2O
Окислительные свойства соединений.Дляванадия наиболее характерна степень окисления +4. Поэтому, соединения ванадия в степени окисления +2, +3 являются сильными восстановителями. Стабилизация их солеобразных производных достигается путем образования двойных солей типа квасцов: М2SO4×V2(SO4)3×24H2O, М2SO4×VSO4×6H2O.
Так, соединения ванадия (II) , без кислорода воздуха постепенно разлагают воду с выделением водорода:
VО + Н2О = 2НVО3 + Н2
В присутствии окислителей довольно легко окисляются до [V(H2O)6]3+ и окраска их раствора становится зеленой.
Оксиды металлов (V), как и ванадаты, ниобаты и т.д. проявляют окислительные свойства, преимущественно в кислой среде, причем в ряду V+5—Nb+5—Ta+5 окислительных характер уменьшается. Например, соединения ванадия (V) могут восстанавливаться до солей ванадила:
V2O5 + 6HС1(конц) ® 2 VОС12 + С12 + 3H2O
При взаимодействии с более сильным восстановителем (КJ) ванадий изменяет степень окисления от + V до +III.
Если проводить восстановление ванадата цинком в кислой среде происходит последовательное восстановление ванадия (V) до степени окисления + IV, +III, +II, о чем свидетельствует последовательное изменение цвета раствора:
VO3- ® VOСL2 ® VCL3 ® VCL2
желто-оранжевая голубая зеленая фиолетовая
Уравнение реакции имеет вид:
2 NaVO3 +3Zn + 6H2SO4 ® 2VSO4+3ZnSO4 + Na2SO4 +6H2O
Для перевода ниобия (V) и в особенности тантала (V) в более низкие степени окисления требуются нагрев и более сильные восстановители.
Перексосоединения характерны для элементов подгруппы ванадия. При действии пероксида водорода Н2О2 на раствор метаванадатов в щелочной среде образуются желтые [VO2(О2)2]3-, сине-фиолетовые [V(О2)4]3- или бесцветные [Та(О2)4]3-, [Nb(О2)4]3- соли (пероксованадаты) /2/:
VO43- + 2Н2О2 = [VO2(О2)2]3- + 2Н2О
Перованадаты устойчивы в нейтральной и щелочных средах. В кислой среде они разлагаются с выделением кислорода и свободных пероксокислот состава НVO4, или
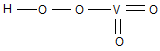
Общая формула пероксокислот Н4V2Oх, где х>7; невыделенны в свободном виде. Их рассматривают как производные пированадиевой кислоты Н4V2O7 в которой часть атома кислорода замещена на пероксогруппу(-О-О-).
Применение
Металлы широко используются для создания сплавов и сталей, из которых изготовляют детали газовых турбин, ядерных реакторов, в ракетной технике, химическом машиностроении и т.д.
Благодаря высокой температуре плавления, малому удельному весу по сравнению с железом, хорошей коррозионной стойкости металлический ванадий и его сплавы используются в качестве конструкционных материалов. Наличие ванадия в сталях способствует облагораживанию структуры металла, удалению азота из металла, улучшению механических свойств, т. е. увеличению пластичности, устойчивости к истиранию и удару, коррозионной стойкости и твердости. Ванадиевые стали применяются в производстве локомотивов, авиационных и тракторных моторов и для других целей.
Соединения ванадия находят применение в химической промышленности в качестве катализаторов, например в производстве серной кислоты контактным методом; некоторые соединения ванадия (например, V2O5) непосредственно служат красителями для стекла и керамики.
Металлический ниобий благодаря большой способности к эмиссии электронов, а также способности адсорбировать при нагревании различные газы, применяется в вакуумной технике, радиотехнике, радиолокационной и рентгеновской аппаратуре. Благодаря своим свойствам металлический ниобий может заменять платину; он служит для изготовления тиглей, капсул, дистиляционных приборов в химических лабораториях.
Сплавы ниобия и тантала, будучи термостойкими сплавами с превосходными техническими характеристиками, незаменимы в областях техники высоких скоростей; это материал для сверхзвуковых самолетов, ракет, межпланетных станций и др. Стали, содержащие ниобий, используются в реактивных турбинах, цилиндрах высокого давления и вращающихся деталях, подвергающихся различным сильным воздействиям. Поскольку металлический ниобий увеличивает прочность сварки, стали, содержащие ниобий, служат для сварки металлов.
Металлический тантал находит самое разнообразное применение. В химической промышленности применяют изготовленные из тантала дистиляционные аппараты, трубопроводы, змеевики для охлаждения или нагревания, кипятильники, резервуары, цистерны, электроды и т. д. Металлический тантал широко используют в электронной промышленности. В электронно-вычислительных машинах применяют криотроны - мельчайшие детали из тантала и ниобия. В области хирургии используют аппараты, инструменты, пластинки и нити из тантала. Тонкие танталовые нити служат для сшивания кровеносных сосудов и нервов, а более толстые нити и пластины из тантала используют в костной хирургии. Металлический тантал успешно заменяет платину, золото, серебро и их сплавы в аппаратуре химической промышленности. Он служит катализатором получения искусственных алмазов из графита, применяется для получения термостойких, жаропрочных, сверхтвердых, нержавеющих сплавов, обладающих большой химической стойкостью.
Из перечисленных областей применения металлов подгруппы ванадия очевидно, что это одни из наиболее ценных металлов современной техники.
Вопросы и упражнения
1. Характерные степени окисления элементов подгруппы V В.
2. Отношение металлов к неметаллам, кислотам, щелочам.
3. Способы получение ванадия, ниобия.
4. Сколько необходимо оксида ванадия (V), содержащего 12% примесей, и кальция для получения 1 кг ванадия?
5. Оксиды в высшей степени окисления. Их устойчивость. Изменение кислотно-основных и окислительно-восстановительных свойств. Примеры.
6. Какие соединения ванадия образуются в растворе при взаимодействииV2O5 с KOH, напишите уравнения реакций.
7. Как изменяется кислотно-основной характер в ряду VО- V2О3- VО2- V2O5. Составьте соответствующие уравнения реакций.
8. Сравните окислительные свойства в ряду V2O5- Nb2O5-Та2О5.
9. Почему ванадий называют «химическим хамелеоном»? Как окрашены соли двух-, трех-, четырех- и пятивалентного ванадия?
10. Осуществите схему: V® VF5 ® VOF5®V2O5.
3.6. Элементы подгруппы VIВ
Побочную подгруппу VI группы периодической системы составляют хром Cr, молибден Mo, вольфрам W. Электронная конфигурация их валентного слоя nS2(n-1)d4, однако у Cr и Mo наблюдается “проскок электрона”:Cr4s1 3d5; Mo -5s1 4d5. Устойчивые степени окисления: Cr +2, ( +3), +6,Mo(+6)возможна +4, +3, W ( +6), редко +5.
Являясь типичными d- металламиCr, Mo, W образуют комплексные соединения с координационными числами 6 и 4, известны комплексы для Мо и W с к.ч. = 8.
