Робота № 10/2. Визначення розчинності та добутку розчинності важкорозчинної солі методом вимірювання електропровідності
Мета роботи. Визначити розчинність, добуток розчинності погано розчинної солі за певної температури і порівняти з величиною, наведеною в довіднику.
Методика роботи. Добуток розчинності - це добуток активностей іонів малорозчинних солей. За відсутності в розчині домішок добуток активностей можна замінити добутком концентрацій. Для солі Мv+Аv- добуток розчинності дорівнює
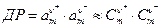 . (1)
. (1)
Для визначення розчинності малорозчинних електролитів, що дисоціюють за схемою:
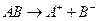 , (2)
, (2)
можна використати метод електропровідності.
Якщо S - розчинність даної речовини, моль/л, а k - питома електропровідність насиченого розчину цієї речовини, то еквівалентна електропровідність розчину дорівнює
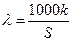 . (3)
. (3)
Як правило, насичений розчин у цьому разі настільки розведений, що l за даної концентрації мало відрізняється від l0 - електропровідності за нескінченного розведення. Величину l0 можна обчислити за рухливостями окремих іонів електроліту. Таким чином, знаючи величину l0 ( 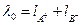 ) і визначаючи дослідним шляхом kсолі можна розрахувати розчинність за рівнянням
) і визначаючи дослідним шляхом kсолі можна розрахувати розчинність за рівнянням
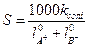 . (4)
. (4)
При цьому треба брати до уваги те, що електропровідність таких розведених розчинів є невеликою і порівняною з електропровідністю води. Тоді величину k розраховують як різницю:
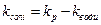 , (5)
, (5)
де kp - питома електропровідність досліджуваного розчину, а kводи - питома електропровідність води.
Електропровідність вимірюють за допомогою містка Кольрауша (рисунок до роботи № 10/1). Вимірювання електропровідності розчину електроліту грунтується на знаходженні величини його опору електричному струму методом компенсації, тобто порівнянням невідомого опору з відомим. Загальний опір посудини з розчином є пропорційним відстані між електродами L і зворотно пропорційним їх площі S:
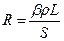 . (6)
. (6)
Якщо в процесі вимірювань b, S, L залишаються сталими, то
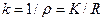 , (7)
, (7)
де k = bL/S - стала посудини.
Порядок роботи.
1. Для визначення сталої посудини (K) необхідно виміряти опір стандартного розчину електроліту (0,02 н КСІ). Значення питомої електропровідності розчину КСl за різних температур наведено в довідниках. У посудину для електропровідності, яку попередньо промито дистильованою водою і два - три рази розчином КСl, наливають 20 - 40 мл розчину 0,02 н КСl. Рівень розчину КСl у посудині повинен перевищувати на 3 - 5 мм верхній край електродів. Через 10 - 15 хв після заповнення посудини приступають до вимірювань опору. Посудину підключають до схеми і визначають величину опору, що відповідає мінімальному сигналу осцилографа. Сталу посудини K розраховують за рівнянням (7). Після закінчення вимірювань для визначення сталої посудини розчин КСl виливають, а посудину старанно промивають.
2. Для визначення електропровідності води беруть двічі перегнану, перекип'ячену воду ( 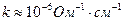 ), заливають її в посудину і через 10 - 15 хв проводять вимірювання опору.
), заливають її в посудину і через 10 - 15 хв проводять вимірювання опору.
3. Невелику кількість (~ 3 г) мало розчинної сполуки (СаСО3, Ва(ОН)2) ретельно розтирають у ступці й переносять у колбу, де промивають декілька разів очищеною водою, електропровідність якої визначено раніше. Промиту сіль заливають водою і через 10 - 15 хв розчин злегка струшують і невелику порцію каламутного, але без осаду, розчину переносять у вимірювальну посудину. Дочекавшись, коли розчин стане прозорим, проводять вимірювання його опору.
4. З осаду, що залишився в колбі, зливають воду, додають нову порцію світлої води і через 10 - 15 хв повторюють попередню операцію. Ці операції оновлення розчину проводять до встановлення сталого значення опору, за яким і розраховують питому електропровідність і розчинність солі згідно з формулами (4) і (5). Експериментальні дані заносять у таблицю:
| Заповнення посудини | Опір розчину | k |
| Вода | ||
| Розчин солі | ||
| 1. | ||
| 2. | ||
| 3. |
5. Знайдену величину розчинності S треба перевести в г-іон/л і розрахувати добуток розчинності. Добуток розчинності 1-1-зарядного електроліту 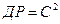 .
.
Література: [21, с. 180-194; 22, с.269-275, 278-280, 285-286; 24, с. 268-281,284-287; 25,с. 249-262,264; 28, с. 123,142].
