Вычисления fЭ, эквивалента и молярной массы эквивалента
Пример 1. Вычислить молярную массу эквивалента H2SO4.
Решение.
В реакциях многопротонных кислот могут участвовать все ионы водорода или только часть их:
H2SO4 + NaOH ↔ NaHSO4 + H2O
H2SO4 + 2NaOH ↔ Na2SO4 + 2H2O
Из уравнений следует: в первой реакции одному иону водорода соответствует 1 моль серной кислоты: fЭ = 1; во второй – одному иону водорода эквивалентна ½ моль H2SO4; fЭ = ½.
Для первой реакции Э (H2SO4)=1 H2SO4; для второй Э (H2SO4)=½ H2SO4.
Следовательно, 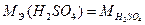 = 98,08 г/моль (реакция 1)
= 98,08 г/моль (реакция 1)
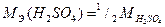 = ½ 98,08 = 49,04 г/моль (реакция 2)
= ½ 98,08 = 49,04 г/моль (реакция 2)
Пример 2. Вычислить молярные массы эквивалента H2С2O4.в реакциях нейтрализации и окисления-восстановления.
Решение.
а) H2C2O4 + 2NaOH ↔ Na2C2O4 + 2H2O
б) H2C2O4 + 2KMnO4 + H2SO4 ↔ 10CO2 + 2MnSO4 + K2SO4 + 8H2O
Из уравнения «а» следует, что в реакцию нейтрализации вступают два иона водорода Н2С2О4, следовательно, одному иону водорода соответствует ½ моль Н2С2О4; fЭ (Н2С2О4) = ½.
Из полуреакции уравнения «б» C2O42– – 2ē ↔ 2CO2 видно, что одному электрону эквивалента ½ моль Н2С2О4; fЭ (Н2С2О4) = ½.
В обеих реакциях МЭ (Н2С2О4) = fЭ × М = ½ × 126,08 г/моль = 63,04 г/моль.
Вычисления концентрации растворов
Концентрация раствора есть число, показывающее, сколько растворенного вещества содержится в массовой или объемной единице раствора.
Способы выражения концентрации раствора:
Процентная концентрация (массовая доля %) – масса растворенного вещества в 100 г раствора: 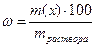
В количественном химическом анализе используют растворы точной концентрации (молярной, молярной концентрации эквивалента).
Молярная концентрация (См, М) – количество растворенного вещества (в молях) в 1 дм3 раствора.
Молярная концентрация эквивалента (СЭ, N, н) – количество вещества эквивалента (в молях) 1 дм3 (л) раствора.
СМ = n (X) / V; СМ = m × 1000 / M × V
СЭ = nэкв (Х) / V; СЭ = m × 1000 / MЭ × V
Если фактор эквивалентности вещества равен 1, то СМ = СЭ.
Растворы точной концентрации, предназначенные для титрования, называют титрованными растворами. Кроме вышеуказанных способов (СМ, СЭ), их концентрация также выражается через титр раствора, титр раствора по определяемому веществу.
Титр раствора – масса вещества в 1 см3 (мл) раствора.
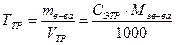
Титр раствора по определяемому веществу (титр соответствия, титриметрический фактор пересчета) – масса определяемого вещества, соответствующая 1 см3 (мл) титрованного раствора.
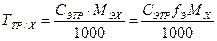
Такие растворы характеризуются также коэффициентом поправки Кп – числом, показывающим, во сколько раз приготовленный раствор крепче или слабее по сравнению с теоретически заданной концентрацией.
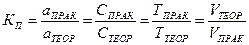
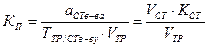
(для стандартных растворов) (для стандартизованных растворов)
Пример 3. 5 г Na2SO4 растворили в 100 г воды. Рассчитать массовую долю растворенного вещества в растворе.
Решение.
Вычисляют массу полученного раствора
m = m1 + m2,
где m1 – масса вещества; m2– масса растворителя.
m = 5 + 100 = 105,0000 г раствора
Рассчитывают массовую долю вещества, составляя пропорцию:
105 – 100%
5 – х% 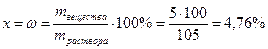
Пример 4. Из 2,5000 г Na2CO3 приготовлено 500 см3 раствора. Вычислить для этого раствора 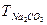 , СМ, СЭ.
, СМ, СЭ.
Решение.
1. Для вычисления титра находят массу вещества, содержащуюся в 1 см3 раствора
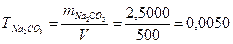 г/см3
г/см3
2. Молярную концентрацию вычисляют по формуле
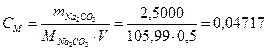 моль/дм3
моль/дм3
3. Молярную концентрацию эквивалента можно найти двумя путями:
а) Находят молярную массу эквивалента Na2CO3
МЭ = ½ М = ½ 105,99 = 53 г/моль
Затем можно воспользоваться известным титром раствора
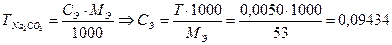 моль/дм3
моль/дм3
б) Или можно воспользоваться величиной навески:
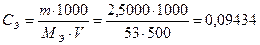 моль/дм3
моль/дм3
Пример 5. Определить массовую долю AgNO3 в 0,05 моль/дм3 раствора (r=1 г/дм3).
Решение.
1. Рассчитывают 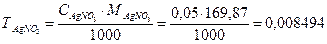 г/см3.
г/см3.
2. Вычисляют массу вещества в 1 дм3 раствора:
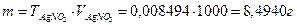
3. Находят содержание вещества в 100 см3 (100 г) раствора нитрата серебра:
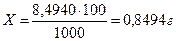 , значит: 0,85%-ный раствор нитрата серебра.
, значит: 0,85%-ный раствор нитрата серебра.
Расчет навески вещества для приготовления титрованного раствора
К исходным веществам для приготовления титрованных растворов предъявляются определенные требования: чистота, постоянство состава, устойчивость, большая величина молярной массы эквивалента.
Если вещество удовлетворяет этим требованиям, раствор титранта готовят по точной навеске, взятой на аналитических весах с точностью до четвертого знака, точная концентрация такого раствора устанавливается в процессе приготовления.
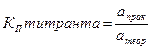
Если вещество не удовлетворяет указанным требованиям, то отвешивают на технических весах приблизительную навеску вещества, на 5-10% больше теоретической. Точную концентрацию такого раствора устанавливают по навеске или раствору стандартного вещества
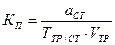
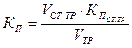
При приготовлении растворов некоторых кислот (серной, хлороводородной) необходимо учитывать, что концентрированные растворы кислот не являются 100%-ными, а содержат воду, объемы таких растворов, используемых для приготовления титрованных растворов, отмеривают мерными цилиндрами (приблизительный объем).
Алгоритм решения
1. Для расчета навески вещества необходимо знать фактор эквивалентности, молярную массу эквивалента вещества, концентрацию и заданный объем титрованного раствора.
Вычислить титр раствора по заданной концентрации:
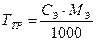 или
или 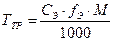
Если требуемая концентрация раствора неизвестна, то ее рассчитывают из других данных условия задачи: из величины титра данного раствора по какому-либо веществу
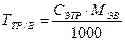 Þ
Þ 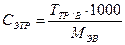
Титр раствора показывает массу исходного вещества в 1 см3 раствора, поэтому для вычисления навески этого вещества нужно вычислить массу вещества в заданном объеме раствора
а = ТТР × VТР
Пример. 6. Какую навеску КОН, содержащего 10% индифферентных примесей, следует взять для приготовления 800 см3 0,2000 моль/дм3 раствора?
Решение.
fЭ(КОН) = 1, следовательно, MЭ(КОН) = МКОН = 56,11 г/моль
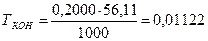 г/см3
г/см3
Рассчитывают навеску чистого КОН
аКОН = 0,01122 × 800 = 8,9722 г
Вычисляют навеску КОН, необходимую для приготовления титрованного раствора, с учетом содержащихся в веществе примесей:
100 – 10 = 90% чистого КОН содержится в исходном веществе, тогда:
а = 8,9722 × 100 / 90 = 9,9777 г
Расчет концентраций и объемов при приготовлении титрованных растворов
Пример 7. Рассчитать объем, в котором надо растворить навеску Ba(OH)2 массой 0,8567, чтобы получить раствор с молярной концентрацией эквивалента 0,1000 моль/дм3.
Решение.
fЭ Ва(ОН)2= ½ , Э Вa(ОН)2= ½ Вa(ОН)2, МЭ = ½М=½171,35 г/моль=85,67 г/моль
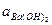 =
= 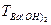 × V Þ
× V Þ 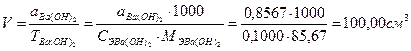
Расчет концентраций и объемов стандартизованных (установленных) титрованных растворов по результатам титрования
В основе решения задач такого типа лежит закон эквивалентов, из которого вытекает основное уравнение титриметрии:
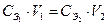 или
или 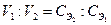
Зная значения трех величин из этих уравнений из результатов титрования, всегда можно рассчитать четвертую.
Способ пипетирования – способ установления точной концентрации раствора, приготовленного по приблизительной навеске вещества. Аликвотную часть стандартного раствора известной концентрации титруют устанавливаемым рабочим раствором (или наоборот).
Алгоритм решения
1. Записать уравнение реакции, лежащей в основе определения.
2. Записать основное уравнение титриметрии, применительно к реагирующим веществам, проставляя в него известные величины. При необходимости проводят дополнительные вычисления некоторых значений.
3. Рассчитать искомую величину по данному уравнению.
4. Вычислить далее другие необходимые по условию задачи величины по соответствующим формулам.
Пример 8. Вычислить СЭ, Т и КП раствора КОН по 0,1000 моль/дм3 раствору Н2SO4, если на 10,00 см3 раствора КОН расходуется 12,00 см3 этого раствора H2SO4.
Решение.
H2SO4 + 2KOH = K2SO4 + 2H2O
1 моль 2 моль
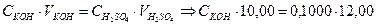
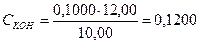 моль/дм3
моль/дм3
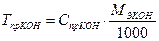
МЭКОН = fЭ × МКОН = 1 × 56,11 = 56,11 г/моль
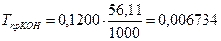 г/см3
г/см3
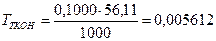 г/см3
г/см3
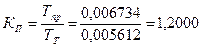 или
или 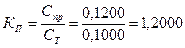
Расчет массового содержания определяемого вещества в анализируемом образце
Алгоритм решения
1. Записать уравнение реакции, лежащей в основе определения.
2. Установить вариант и способ титрования, фактор эквивалентности и молярную массу эквивалента определяемого вещества.
3. Вычислить титр раствора по определяемому веществу.
4. Рассчитать массовое содержание определяемого вещества путем умножения вычисленного титра на объем израсходованного титранта.
5. При необходимости перед расчетом массового содержания провести дополнительные вычисления определенных величин, исходя из условия задачи.
Пример 9. Вычислить массу КОН, содержащегося в навеске, если на ее титрование было израсходовано 19,44 см3 раствора H2SO4 с молярной концентрацией эквивалента 0,1410 моль/дм3.
Решение.
2KOH + H2SO4 = K2SO4 + 2H2O
2 моль 1 моль
Прямое титрование, способ отдельных навесок, fЭ (КОН) = 1,
МЭ(КОН)=56,11 г/моль
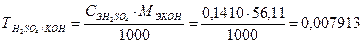 г/см3
г/см3
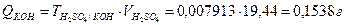
Расчет массовой доли (w%) определяемого вещества в анализируемом образце
Алгоритм решения
Действия 1-5 таких типовых задач провести аналогично приведенному выше алгоритму.
6. Далее, принимая исходную навеску за 100%, составить пропорцию:
а – 100%
Q – (w%) (w%) = Q × 100 / а
Вопросы для подготовки к промежуточной аттестации (экзамен)
1. Что называется титрантом? Вычислить титр 0,02н раствора уксусной кислоты.
2. Общий принцип и области применения титриметрических методов анализа
3. Относительные и абсолютные ошибки при титровании.
4. Раствор серной кислоты оттитрован гидроксидом натрия до слабокислой среды.
Правильный ли получен результат?
5. Укажите точность отсчета объема титранта по бюретке. Какие весы и посуда используются для приготовления растворов с точной концентрацией?
6. Молярная концентрация эквивалента. Вычислите нормальность раствора, в 100 мл которого содержится 0,49 г серной кислоты.
7. Как правильно приготовить титрованный раствор? Как получить 100 мл 0,1н раствора из 1н раствора?
8. Принципы аналитического определения. Требования к аналитическим химическим реакциям.
9. Какая посуда ополаскивается перед титрованием раствором титранта, титруемым раствором, дистиллированной водой и почему?
10. Кислотно-основное титрование. Укажите систему для которой точка эквивалентно- сти находится в кислой среде.
11. Какие факторы влияют на величину скачка кривой титрования?
12. Рассчитать рН в точке титрования, если к 100 мл 0,1н HCl добавили 90 мл 0,1н раствора NaOH.
13. Применение титриметрических методов в анализе пищевых продуктов
14. Методы эталонной шкалы, добавок, градуировочного графика
15. Прямое, обратное, заместительное титрование, особенности применения.
16. Достоинства и недостатки титриметрических методов анализа
17. Основной закон светорассеяния.
18. Общий принцип и области применения фотометрических методов анализа.
19. Относительный и абсолютный показатели преломления луча света.
20. Оптически активные вещества.
21. Физический смысл величин, входящих в уравнение Рэлея.
22. Объединенный закон Бугера-Ламберта-Бера.
23. Молярная рефракция, уравнение Лорентца-Лоренца.
24. Принцип поляриметрического метода анализа.
25. Графическая зависимость “оптической плотности” от концентрации суспензии.
26. Спектральные характеристики окрашенных растворов, выбор сфетофильтра.
27. Оптическая схема рефрактометра, правила работы на приборе.
28. Расчет молярного вращения плоскости поляризации оптически активных веществ.
29. Определение сульфатов и хлоридов методом фотонефелометрии.
30. Метод калибровочного графика, правила построения.
31. Рефрактометрический способ идентификации органических веществ.
32. Применение поляриметрического метода в анализе пищевых продуктов.
33. Методы эталонной шкалы, добавок, градуировочного графика.
34. Фотометрические реакции, их типы.
35. Устройство поляриметра, назначение анализатора и поляризатора.
36. Кривые фототурбидиметрического титрования.
37. Пределы обнаружения и достоверность фотометрических методов.
38. Достоинства и недостатки рефрактометрического метода анализа.
39. Сущность хроматографического процесса.
40. Природа светопоглощения в ультрафиолетовом, видимом и инфракрасном
участках спектра.
41. Области практического применения физико-химических методов анализа.
42. Классификация хроматографических методов анализа.
43. Методы разделения смесей газов, жидкостей, твердых веществ, ионов.
